
分析 碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,根据二氧化碳的质量可以计算碳酸钠的质量,进一步可以计算纯碱样品中碳酸钠的质量分数.
解答 解:设碳酸钠的质量为x,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
106 44
x 4.4g
$\frac{106}{x}$=$\frac{44}{4.4g}$,
x=10.6g,
答:纯碱样品中碳酸钠的质量是10.6g.
(2)纯碱样品中碳酸钠的质量分数为:$\frac{10.6g}{16g}$×100%=66.25%,
答:纯碱样品中碳酸钠的质量分数为66.25%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:解答题
| 物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 | MgCO3 |
| 颜色 | 白色 | 白色 | 淡黄色 | 白色 | 白色 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | Ca(OH)2+H2SO4═CaSO4+2H2O | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2 | D. | 2HCl+CuO═CuCl2+H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 开发新能源(太阳能、潮汐能、风能等),减少化石燃料的使用 | |
| B. | 限制化工发展,关停化工企业,消除污染源头 | |
| C. | 用第四代LED绿色光源代替白炽灯 | |
| D. | 提倡乘坐公共交通工具,骑自行车或步行等出行方式 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 浓硫酸与浓盐酸都具有吸水性 | |
| B. | 稀硫酸与稀盐酸都可以除铁锈 | |
| C. | 打开盛有浓硫酸与浓盐酸的试剂瓶瓶塞瓶口都有白雾 | |
| D. | 浓硫酸与浓硝酸长期放置液体的质量都会减少 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 加入NaOH溶液的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.0 | 7.0 | 11.0 | 12.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
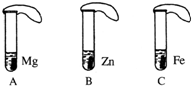 一般情况下,金属越活泼,与酸反应速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下实验(如图).
一般情况下,金属越活泼,与酸反应速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下实验(如图).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com