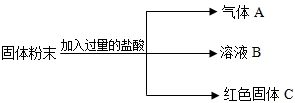
有一包固体粉末,可能含有NaCl、Ba(NO3)2、Na2SO4、Na2CO3中的几种,为确定它们做如下实验:
(1)将该固体粉末溶于水,搅拌后有白色沉淀生成;(2)在上述含白色沉淀的溶液中加入稀HNO3,则沉淀全部消失.由此推断固体粉末中肯定有 ______,肯定没有 ______,可能有 ______.
【答案】分析:NaCl、Ba(NO3)2、Na2SO4、Na2CO3四种物质间可以发生的反应有:Ba(NO3)2分别能与Na2SO4、Na2CO3生成BaSO4和BaCO3的白色沉淀,白色沉淀BaCO3可以溶于稀硝酸放出气体CO2,白色沉淀BaSO4不能溶解于稀硝酸;
根据以上物质间的反应关系,结合实验中的现象,分析、判断固体粉末的组成.
解答:解:NaCl、Ba(NO3)2、Na2SO4、Na2CO3四种物质中,Ba(NO3)2分别能与Na2SO4、Na2CO3生成BaSO4和BaCO3的白色沉淀;
根据实验中固体粉末溶于水生成能溶于稀硝酸的白色沉淀,而白色沉淀BaCO3可以溶于稀硝酸放出气体CO2、白色沉淀BaSO4不能溶解于稀硝酸,可判断固体粉末中一定含有Ba(NO3)2和Na2CO3、一定不含Na2SO4;
由于氯化钠不能与另外三种物质发生反应,固体粉末中是否含有NaCl对实验中的现象不产生影响,因此,可判断固体粉末中可能含有NaCl;
故答案为:Ba(NO3)2、Na2CO3;Na2SO4;NaCl.
点评:此类问题解决思路一般为:根据物质的性质及物质间可能发生的反应及反应时出现的现象,结合实验中所出现的现象,分析并判断混合物的组成.