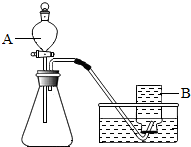
解:(1)分液漏斗方便加液体药品,也可以控制反应的速度,如果用双氧水和二氧化锰制氧气就不需要加热,双氧水在常温下不易分解,其中二氧化锰起催化作用,实验前,首先要检查装置的气密性,故答案为:①分液漏斗;②H
2O
2;③A;催化;④检查装置的气密性;
(2)高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;补充猜想Ⅲ:MnO
2和K
2MnO
4都放出氧气,因为MnO
2和K
2MnO
4都含有氧元素;在250℃条件下加热一段时间,冷却后测得MnO
2的质量不变,则猜想Ⅰ是错误的;在试管口放一个带火星的木条,观察到木条复燃,说明有氧气生成;设计的实验方案是:取等量的锰酸钾固体于两支试管中,一支试管中加入氧化钾,一支试管中不加入氧化钾.用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.故答案为:2KMnO
4
K
2MnO
4+MnO
2+O
2↑;MnO
2和K
2MnO
4都放出氧气;MnO
2和K
2MnO
4都含有氧元素;①Ⅰ;②在试管口放一个带火星的木条,观察到木条复燃;取等量的锰酸钾固体于两支试管中,一支试管中加入氧化钾,一支试管中不加入氧化钾.用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.
(3)碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,配平即可;丙同学设计了实验室制取CO
2装置,出现了一个错误,纠正方法是把排水法改为向上排空气法;此装置的优点是:可以控制反应的速度;故答案为:①把排水法改为向上排空气法;②CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;③可以控制反应的速度;
分析:分液漏斗方便加液体药品,也可以控制反应的速度;实验前,首先要检查装置的气密性,制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO
2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.设计的实验方案是:取等量的锰酸钾固体于两支试管中,一支试管中加入氧化钾,一支试管中不加入氧化钾.用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.氧气的检验方法是:将带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气.丙同学设计了实验室制取CO
2装置,出现了一个错误,纠正方法是把排水法改为向上排空气法;此装置的优点是:可以控制反应的速度.
点评:本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和实验方案的设计等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


 K2MnO4+MnO2+O2↑;MnO2和K2MnO4都放出氧气;MnO2和K2MnO4都含有氧元素;①Ⅰ;②在试管口放一个带火星的木条,观察到木条复燃;取等量的锰酸钾固体于两支试管中,一支试管中加入氧化钾,一支试管中不加入氧化钾.用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.
K2MnO4+MnO2+O2↑;MnO2和K2MnO4都放出氧气;MnO2和K2MnO4都含有氧元素;①Ⅰ;②在试管口放一个带火星的木条,观察到木条复燃;取等量的锰酸钾固体于两支试管中,一支试管中加入氧化钾,一支试管中不加入氧化钾.用同样火焰的酒精灯加热,用相同规格的集气瓶,用排水法收集一瓶气体,收集一瓶氧气所用的时间作比较,确定锰酸钾的分解是否与氧化钾有关系.

 某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.
某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验. 某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.
某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.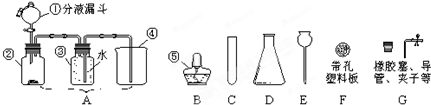
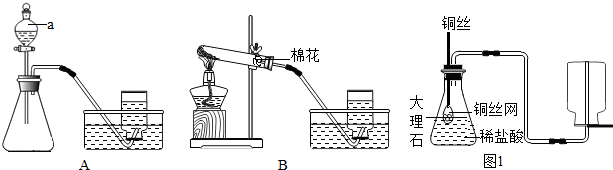
 某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.
某兴趣小组根据实验室提供的仪器和药品进行了氧气的制备实验.