金属材料在生产、生活中有着广泛的应用.
(1)人类每年从自然界提取大量的金属,其中提取量最大的是铁.用赤铁矿(主
要成分为Fe2O3)和一氧化碳炼铁的化学方程式为________.
(2)每年世界上钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失,铁在空气中锈蚀,实际上是铁跟________等物质共同相互作用的结果.
(3)颗粒达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”.实验室制备的方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2发生置换反应,生成“纳米铁”.写出生成“纳米铁”的化学方程式________.
(4)某化学探究小组为了验证铁、铜、镁、汞的金属活动性顺序,设计了如下实验方案:
①将大小一样的铁片和镁片分别加入到溶质质量分数相同的稀盐酸中;
②将铜片加入到硝酸汞溶液中,铜片上出现银白色物质;
③将金属片A加入到溶液B中.根据实验①判断出镁的金属活动性比铁强,依据的现象是________,根据实验②的现象得出的结论是________.
(5)将一定质量镁片加入到50g某稀硫酸中恰好完全反应后,放出0.4g氢气,试计算该稀硫酸中溶质的质量分数.39.2%
解:(1)由高炉炼铁的原理,答案为:Fe
2O
3+3CO

Fe+3CO
2(1分)
(2)钢铁在空气中锈蚀,被氧化成三氧化二铁,故答案为:氧气、水(1分)
(3)题中所给信息:反应物为氢气和氧化铁,反应条件为高温,反应类型为置换反应,产物有铁,另一产物就为氯化氢,故答案为:FeCl
2+H
2
Fe+2HCl(1分)
(4)因金属活动性镁强于铝,故:镁片与盐酸反应比铁片与盐酸反应剧烈;(1分)
(金属活动顺序中,铜排在汞前面,)铜比汞的金属活动性强,(故铜可置换出汞;)(1分)
(5)镁投入酸中与酸发生了反应,产生的氢气的质量与消耗的酸的质量之比与它们的式量之比相等
设稀硫酸中硫酸的质量为X,则
Mg+H
2SO
4=MgSO
4+H
2↑(1分)
98 2
X 0.4g(1分)
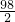
=
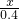
(或98:2=X:0.4g)(参与反应的物质的质量之比等于物质的式量之比)(1分)
X=19.6g(1分)
稀硫酸中溶质的质量分数为19.6g/50g×100%=39.2%(1分)
答:稀硫酸中溶质的质量分数为19.6g/50g×100%=39.2%.
分析:根据炼铁原理及钢铁腐蚀能解出(1)(2);(3)为信息处理题,反应物为氢气和氧化铁,反应条件为高温,反应类型为置换反应,产物有铁,另一产物就为氯化氢,实质是氢置换出铁.金属活动性越强,与酸反应置换出氢气就越容易;金属活动性强的金属可以将金属活动性弱的金属从其盐溶液中置换出来.
点评:本题考查了炼铁原理、钢铁的腐蚀、金属活动性顺序以及应用反应方程式进行化学计算,同时也培养学生的信息处理能力(如(3)).

 Fe+3CO2(1分)
Fe+3CO2(1分) Fe+2HCl(1分)
Fe+2HCl(1分)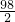 =
=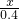 (或98:2=X:0.4g)(参与反应的物质的质量之比等于物质的式量之比)(1分)
(或98:2=X:0.4g)(参与反应的物质的质量之比等于物质的式量之比)(1分)


 (2013?丰台区二模)金属材料在生产、生活中有着广泛的应用.
(2013?丰台区二模)金属材料在生产、生活中有着广泛的应用.