向Na2CO3溶液里滴加稀盐酸,开始时无气泡产生,后来才有气泡产生;向稀盐酸里滴加Na2CO3溶液时,立即就有气泡产生.下列推测合理的是( )
A.Na2CO3跟稀盐酸不反应
B.产生的气泡是挥发出来的氯化氢气体
C.稀盐酸不足量时,主要发生的反应是Na2CO3+2HCl=2NaCl+H2O+CO2↑
D.Na2CO3过量时,主要发生的反应是Na2CO3+HCl=NaHCO3+NaCl
【答案】分析:①向碳酸钠溶液中滴加盐酸,盐酸少量,反应方程式为Na2CO3+HCl=NaHCO3+NaCl,没有二氧化碳生成;
②当向盐酸中滴加Na2CO3溶液时,盐酸过量,发生反应Na2CO3+2HCl=H2O+2NaCl+CO2↑,立即有CO2气体产生.
解答:解:A、Na2CO3跟盐酸可以反应放出二氧化碳.Na2CO3+2HCl=H2O+2NaCl+CO2↑,故本选项错误;
B、盐酸挥发是在溶液表面发生的,不会产生气泡.故本选项错误;
C、向碳酸钠溶液中滴加盐酸,稀盐酸不足量,反应方程式为Na2CO3+HCl=NaHCO3+NaCl,没有二氧化碳生成;故本选项错误;
D、Na2CO3过量,即稀盐酸不足量时,反应方程式为Na2CO3+HCl=NaHCO3+NaCl,没有二氧化碳生成;故本选项正确;
故选D.
点评:本题重点考查了Na2CO3和与NaHCO3与盐酸反应不同现象,并对Na2CO3和HCl过量性反应进行探究.



 阅读快车系列答案
阅读快车系列答案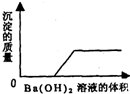 (1)某一由盐酸、碳酸钠溶液、稀硫酸、氯化铜溶液四种物质中的两种混合形成的混合溶液,现向该混合溶液中滴入氢氧化钡溶液,产生沉淀的质量与加入氢氧化钡溶液体积的关系如图所示.该混合溶液的组成是
(1)某一由盐酸、碳酸钠溶液、稀硫酸、氯化铜溶液四种物质中的两种混合形成的混合溶液,现向该混合溶液中滴入氢氧化钡溶液,产生沉淀的质量与加入氢氧化钡溶液体积的关系如图所示.该混合溶液的组成是