
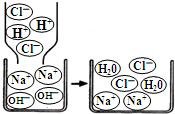
 了解物质构成的微观奥秘,能帮助我们更好地认识物质变化的本质.
了解物质构成的微观奥秘,能帮助我们更好地认识物质变化的本质.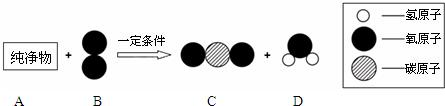
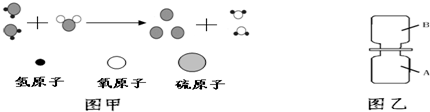
| A.属于置换反应 | B.反应前后元素种类不变 |
| C.反应前后分子数目不变 | D.反应前后原子种类、数目均不变 |
 ×100%=36克,水中氢元素的质量为72g×
×100%=36克,水中氢元素的质量为72g×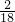 ×100%=8克;因为碳元素、氢元素都来自A,故A中各元素的质量比m(C):m(H)=36:8=9:2;已知A的相对分子质量为44,则A的化学式为C3H8,故该反应的化学方程式是C3H8+5O2
×100%=8克;因为碳元素、氢元素都来自A,故A中各元素的质量比m(C):m(H)=36:8=9:2;已知A的相对分子质量为44,则A的化学式为C3H8,故该反应的化学方程式是C3H8+5O2 3CO2+4H2O.③根据此反应的特点和化学反应的实质,该反应不属于置换反应,反应前后反应前后元素种类不变,原子种类、数目均不变;分子数目发生了变化;故选BD.
3CO2+4H2O.③根据此反应的特点和化学反应的实质,该反应不属于置换反应,反应前后反应前后元素种类不变,原子种类、数目均不变;分子数目发生了变化;故选BD. 3CO2+4H2O;③BD.
3CO2+4H2O;③BD.

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 26、了解物质构成的微观奥秘,能帮助我们更好地认识物质变化的本质.
26、了解物质构成的微观奥秘,能帮助我们更好地认识物质变化的本质.
 分别表示N2、H2、NH3三种分子.为了便于理解,我们将在固体催化剂表面(用
分别表示N2、H2、NH3三种分子.为了便于理解,我们将在固体催化剂表面(用 表示)合成氨的过程简化为下图中的五个步骤,请按照正确的步骤进行排序
表示)合成氨的过程简化为下图中的五个步骤,请按照正确的步骤进行排序

查看答案和解析>>
科目:初中化学 来源: 题型:
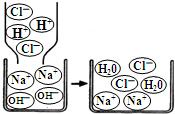 了解物质构成的微观奥秘,能帮助我们更好地认识物质变化的本质.
了解物质构成的微观奥秘,能帮助我们更好地认识物质变化的本质.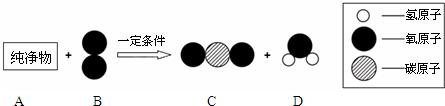
| A.属于置换反应 | B.反应前后元素种类不变 |
| C.反应前后分子数目不变 | D.反应前后原子种类、数目均不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?石景山区一模)了解物质构成的微观奥秘,能帮助我们更好地认识物质及其变化的本质.
(2013?石景山区一模)了解物质构成的微观奥秘,能帮助我们更好地认识物质及其变化的本质.| 微观示意图 |  | |||
 |
 |
 |
 | |
 表示A,A和B在一定条件下反应生成C和D,则C和D的化学式分别为
表示A,A和B在一定条件下反应生成C和D,则C和D的化学式分别为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com