
【题目】NaOH是化学实验中常用的试剂。
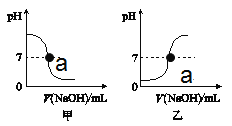
(1)将某NaOH溶液逐滴滴入一定量的某硫酸中,如图所示的图像合理的是______(填“甲”或“乙”),写出该反应方程式___________,a点表示的意义为 ________。
(2)向长期敞口放置的NaOH溶液中滴加硫酸时,意外发现有气泡产生,请解释其原因 _______________。
【答案】 乙 2NaOH +H2SO4 = Na2SO4 + 2H2O NaOH 和H2SO4恰好完全反应 NaOH与空气中二氧化碳反应,产生碳酸钠与盐酸反应产生二氧化碳气体
【解析】根据所学知识和题中信息知,(1)将某NaOH溶液逐滴滴入一定量的某硫酸中,图像合理的是乙,pH>7溶液呈酸性,pH<7溶液呈碱性,pH=7溶液呈中性。该反应方程式是2NaOH +H2SO4 = Na2SO4 + 2H2O,a点pH=7溶液呈中性,表示的意义为NaOH 和H2SO4恰好完全反应。(2)向长期敞口放置的NaOH溶液中滴加硫酸时,意外发现有气泡产生,其原因是NaOH与空气中二氧化碳反应,产生碳酸钠与盐酸反应产生二氧化碳气体。
点睛∶pH>7溶液呈酸性,pH<7溶液呈碱性,pH=7溶液呈中性。NaOH与空气中二氧化碳反应,氢氧化钠应密封保存。


科目:初中化学 来源: 题型:
【题目】甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是( )
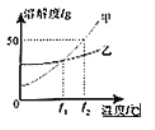
A.t1℃时,甲、乙两物质的溶解度相等
B.乙物质的溶解度大于甲物质的溶解度
C.t2℃时,乙的饱和溶液降温至t1℃,乙溶液变为不饱和溶液
D.t2℃时,甲物质的饱和溶液降温至t1℃,溶液中溶质质量一定不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图判断,下列说法错误的是( )
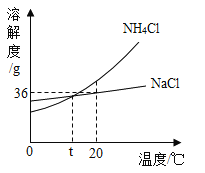
A. NaCl和NH4Cl的溶解度都随温度升高而增大
B. 将20℃时某NH4Cl溶液降温到0℃,其溶质质量分数一定减小
C. 20℃时,20gNaCl加入到50g水中,搅拌后不能全部溶解
D. t℃时,NH4Cl饱和溶液和NaCl饱和溶液溶质质量分数相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列实验装置图,以下说法中错误的是

A. 实验开始先通一会儿CO,再用酒精喷灯加热
B. a处固体由黑色逐渐变为红棕色
C. 反应过程中可观察到b处的澄清石灰水变浑浊
D. CO有毒,通常在c处将其点燃或用气囊收集以防止污染空气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中然烧的实验(如图1)。
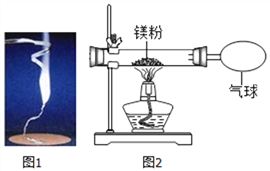
同学们观察到镁条在空气中剧烈燃烧,发出耀眼的白光,因此镁在军事上作_________;
同时同学们还观察到产生的大量白烟弥漫到空气中,最后一些白色固体掉落在仪器A上。
(1)上述仪器A名称是____________。
(2)同学们通过称量发现:在仪器A上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是:____________。
(3)小红按下图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁( Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
实验操作 | 实验现象及结论 |
_______________________ | ________________ |
【反思与交流】
①写出镁条燃烧生成氮化镁的化学方程式为____________________;
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:_________________;
③同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识:___________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是浓盐酸试剂瓶上标签的部分内容,回答下列问题。

(1)该浓盐酸中溶质与溶剂质量比为_______;
(2)使用一段时间后,浓盐酸的溶质质量分数小于36%,可能原因是 _____________;
(3)盐酸等许多酸都能使紫色石蕊试液变红,是因为酸溶液中都含有______(用化学符号表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在硫酸与硫酸铜的混合溶液200g中,滴入40%的NaOH溶液100g,恰好完全反应,记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示.

回答:
(1)与硫酸铜反应的氢氧化钠溶液的质量为__________g。
(2)此硫酸的溶质质量分数为________?
(3)反应后溶液溶质的质量分数是_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸锌可作为食品添加剂。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的FeO、CuO。工艺流程图如下:(假设每一步骤反应均完全)

⑴为提高矿石的溶解速度,操作1是___________ 。
⑵菱锌矿溶解后所得的溶液中金属阳离子有_____________种。
⑶反应1中H2O2转化为H2O,同时有Fe2(SO4)3生成,写出反应1中生成Fe2(SO4)3的化学方程式___________________________。
⑷结晶之前,溶液中除了硫酸锌,还一定存在的溶质是_________________。
⑸硫酸锌晶体的溶解度曲线如下图所示,若要获得ZnSO4·7H2O晶体,应控制结晶时的温度范围为____________________。

⑹流程中还可能得到一种紫罗兰色晶体(NH4)xFey(SO4)z·7H2O。已知该化合物中氮、铁元素质量比为1:4,则x:y :z=________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家发现,通过简单的化学反应,可以将树木的纤维素变成超级储能装置,下图是该反应的微观示意图,下列说法正确的是________
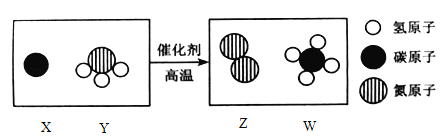
A.W物质中碳元素的质量分数为50%
B.化学反应前后原子的种类、个数、质量均保持不变
C.上图中涉及的化合物有3种
D.参加该反应中Z与W的分子个数比为__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com