
【题目】写出下列化学方程式,并回答相关问题。
(1)天然气燃烧:__________,该反应__________(填写“放热”或“吸热”)。
(2)稀硫酸除铁锈:__________,溶液由无色变为__________.
(3)少量硫酸铵固体与熟石灰混合研磨:__________;检验该气体可用__________试纸。
(4)将光亮的铁丝插入装有硫酸铜溶液中:________,反应所得溶液的质量________(填“大于”或“等于”或“小于”)反应前溶液的质量。
(5)若不慎将浓硫酸沾到皮肤或衣服上,应立即用大量的水冲洗,然后涂上3%~5%的NaHCO3溶液__________;该反应的基本类型是__________.
【答案】CH4+2O2![]() CO2+2H2O 放热 Fe2O3+3H2SO4═Fe2(SO4)3+3H2O 黄色 (NH4)2SO4+Ca(OH)2═CaSO4+2NH3↑+2H2O 湿润的红色石蕊 Fe+CuSO4=FeSO4+Cu 小于 2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑ 复分解反应
CO2+2H2O 放热 Fe2O3+3H2SO4═Fe2(SO4)3+3H2O 黄色 (NH4)2SO4+Ca(OH)2═CaSO4+2NH3↑+2H2O 湿润的红色石蕊 Fe+CuSO4=FeSO4+Cu 小于 2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑ 复分解反应
【解析】
(1)天然气的主要成分是甲烷,甲烷在点燃条件下燃烧生成二氧化碳和水,反应的化学方程式为CH4+2O2![]() CO2+2H2O;该反应属于放热反应;
CO2+2H2O;该反应属于放热反应;
(2)铁锈的主要成分是氧化铁,与硫酸反应生成硫酸铁和水,反应的化学方程式是:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;溶液由无色变为黄色;
(3)硫酸铵固体与熟石灰混合研磨生成硫酸钙、水和二氧化碳,反应的化学方程式是为:(NH4)2SO4+Ca(OH)2═CaSO4+2NH3↑+2H2O;生成的氨气可用湿润的红色石蕊试纸检验,若变蓝,说明是氨气;
(4)铁丝与硫酸铜溶液反应生成硫酸亚铁溶液和铜,反应的化学方程式为:Fe+CuSO4=FeSO4+Cu;56份质量的铁能置换出64份质量的铜,由质量守恒定律,反应所得溶液的质量小于反应前溶液的质量;
(5)NaHCO3溶液与稀硫酸反应生成硫酸、水和二氧化碳,反应的化学方程式为2NaHCO3+H2SO4═Na2SO4+2H2O+2CO2↑;该反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应。


科目:初中化学 来源: 题型:
【题目】某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)镁条与氧气反应的现象是_____
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律。我_____(“同意" 或“不同意" )小明的观点,因为_____
(3)小红按下图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
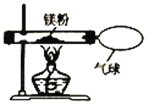
[提出问题]黄色固体是什么呢?
[查阅资料]
②氧化镁为白色固体
③镁能与氮气反应生成黄色的氮化镁( Mg3M2.)固体;
④氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
[做出猜想]黄色固体为Mg3N2
[实验探究]请设计实验,验证猜想
实验操作:_____
实验现象:_____
实验结论:_____
[反思与交流]空气中N2的含量远大于O2的含量,而铁条在空气中燃烧生成的氧化镁却远多于氮化镁,为什么?请给出合理的解释_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钢铁是重要的金属材料。
I.(1)下列铁制品的用途中,利用金属导热性的是_____(填字母,下同)。
A铁钳 B铁锅 C水龙头
(2)目前世界上已有 50%以上的废金属得到回收利用,其目的是_____。
A节约金属资源 B防止钢铁生锈 C减少对环境的污染
(3)全世界每年因锈蚀损失的钢铁,约占年产量的十分之一。请写出一种防止铁制品生锈的方法:____________________________。
(4)“纳米α-Fe 粉”可用于食品保鲜,称之为“双吸剂”,是因为它能够吸收空气中的___________________________________。
II.工业炼铁的设备是高炉,所用的原料有焦炭、铁矿石、石灰石等。请回答下列问题:
(1)写出以赤铁矿为原料在高温下炼铁的化学方程式:________________________________;
(2)加入焦炭,其作用除了燃烧放热提高炉温外,还能________________________________。
Ⅲ.某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究 CO 与 Fe2O3 反应后的产物。所用装置如图所示。
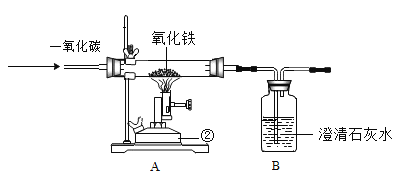
(1)如果实验成功,请回答下列问题:
①实验过程中硬质粗玻璃管内的现象:_____。
②B 装置中发生反应的化学方程式_____。
③实验开始时先向装置内通一段时间的 CO 气体,其目的是_____。
④有同学认为该装置有一明显缺陷,你认为该如何改进__________________________________________________。
Ⅳ.某钢铁公司用 2000t 含氧化铁 80%的赤铁矿石炼铁,最多可炼出含杂质 2.5%的生铁__________________________吨?(请写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(9分)(1)从海水中提取出的粗盐中除了NaCl外,还含有泥沙等杂质。请完善下列实验室中除去泥沙等杂质的实验步骤,并回答相关问题:
![]()
其中操作1的名称是 ;在过滤操作中要用到的玻璃仪器有烧杯、玻璃棒、 (填仪器名称);在加热蒸发过程中,当蒸发皿中 时,停止加热。
(2)海水提取出粗盐后的母液中,还含有较多的氯化镁,用氯化镁可制得金属镁。其示意图如下:
![]()
①物质X是 (填名称)。
②写出反应Ⅰ中发生反应的分步的化学方程式 、 。
③上述一系列转化过程中,没有涉及的基本反应类型是 。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(3)工业上可用电解饱和NaCl溶液的方法制得烧碱、氯气和氢气,请写出该反应的化学方程式: 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列实验装置图,回答问题。
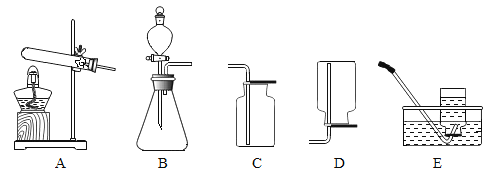
(1)实验室用双氧水和二氧化锰制取氧气的化学方程式为________________,发生装置为________(填字母序号)。若反应过于剧烈,从实验安全角度考虑,可以采取的措施有______________(写一种即可)。
(2)实验室用高锰酸钾制取氧气,为进一步研究高锰酸钾的分解产物,某兴趣小组查阅资料,并取一定质量的高锰酸钾加热使之完全分解,进行下表所示的实验。
(实验内容):
编号 | 实验内容 | 实验现象 | 实验结论 |
1 | 取反应后固体剩余物0.2g加入5mL%的H2O2溶液 | 剧烈反应,放热,产生大量气泡 | 生成物中的MnO2催化分解H2O2 |
2 | 取0. 2g MnO2加入5mL_____(填H2O2溶液的溶质质量分数)的H2O2溶液 | 平稳反应,放热,持续产生气泡 | MnO2催化分解H2O2 |
3 | 取反应后固体剩余物1. 0g,加入足量水,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | 固体剩余物中无_____ |
(实验分析):
①完善上表中的填空内容:实验2________,实验3________。
②实验2的目的是________。
③经讨论,实验1的结论不正确,理由是________。
(资料):在43.9℃~377.9℃范围中,KMnO4受热分解时,会发生以下两个反应:
a.![]()
b.![]()
④取8.0g KMnO4加热使之完全分解,生成O2的质量可能为________(填字母序号);
A0.81 g B1.08 g C1.42 g D1.62 g
⑤资料显示,KMnO4在43.9℃~377 .9℃范围中的失重率(O2与KMnO4的质量比)为18.0%。结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以____(填“a”或“b”)为主。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某学习小组同学在用高锰酸钾做实验时不慎沾到手上,导致皮肤变成了棕褐色,老师提供草酸溶液给同学洗手,棕褐色立刻消失。同学对草酸产生了兴趣,经请教老师获知,草酸(H2C2O4)在通常状况下为固体,是一种易溶于水的酸,广泛存在于植物源食品中。草酸固体在浓硫酸的催化作用下,受热分解生成碳的氧化物和水,小组同学对生成物中碳的氧化物的种类进行了如下探究。
(提出问题)草酸受热分解的生成物中有哪几种碳的氧化物?
(进行猜想)猜想1:只有CO 猜想2:只有CO2 猜想3:同时含有CO和CO2。
(查阅资料)
①一氧化碳不能与澄清石灰水反应。
②浓硫酸有吸水性,能吸收气体中混有的水蒸气,使气体变干燥。
(实验探究)同学设计了如图1所示装置进行实验:
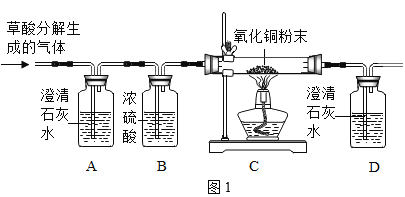
(1)实验时,当观察到装置A中的现象为___,说明草酸的分解产物中有CO2气体存在。
(2)为了实验安全,在实验开始应先通一会儿气体,再___,实验过程中,观察到C中现象是___,由此得出草酸分解产物有CO气体存在。同学甲认为,该套装置存在明显的缺陷,你的改进方法是___。
(3)装置C中直玻璃管内发生反应的化学方程式为___。
(实验结论)(4)通过实验,可得到的结论是猜想3正确。请写出草酸在浓酸的催化下,受热分解的化学方程式:___。
(问题讨论)(5)草酸与高锰酸钾反应的化学方程式为:3H2C2O4+2KMnO4=K2CO3+2MnO2+3H2O+5CO2↑;又知在化学反应中,有元素化合价升高的反应物为还原剂,有元素化合价降低的反应物为氧化剂,则此反应中的氧化剂是___。
(定量计算)(6)测定高锰酸钾样品中高锰酸钾的质量分数(高锰酸钾样品中含少量杂质)。同学们设计了如图2的实验装置,取1g高锰酸钾固体样品放于试管中,实验中将注射器内的草酸溶液(足量)完全注入试管中。当试管中不再产生气泡时读数得到量筒中水的体积为330毫升。已知实验条件下二氧化碳的密度为2g/L。计算该样品中高锰酸钾的质量分数___。(写出计算过程)
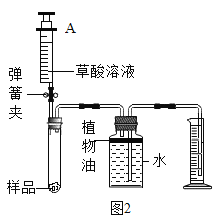
(实验反思)(7)图2中水面上方封了一层植物油,目的是___。实验结束后,学习小组的同学对该实验进行了反思,同学乙认为用该装置测得的样品中高锰酸钾的质量分数偏高,你认为原因是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
地球是一个蓝色的水球,自然界中的水有如图1所示的循环过程。

地球上的淡水资源只占总水量的2.53%,且分布不均匀。上图2为我国部分地区淡水储量及年人均拥有量的相关数据。沿海地区解决淡水危机的有效措施之一是海水淡化。图3是海水淡化过程简单示意图。

最近,科学家创造了强大的“吸汽材料”(MOFs材料)并开发出在沙漠也能“吐水”的“集水神器”(图4)。MOFs材料具有亲水孔道,对空气中的水蒸气具有超强的吸附作用。MOFs材料可选择的金属原料很多,像MOF-801使用的氧氯化锆(ZrOCl2)原料,价格比较昂贵。而合成MOF-303的原料是便宜易得的氯化铝(AlCl3),可大大降低成本。
水在居民生活、农业灌溉和工业生产中充当重要角色。工业上,水常用作冷却剂、溶剂或原料。如工业上通过电解氯化钠和水的溶液,可获得氢气、氯气和氢氧化钠(易溶于水,俗称烧碱)三种重要化工产品。
依据文章内容,回答下列问题。
(1)海水蒸发过程中,不发生变化的是_____(填序号)。
A 分子质量 B 分子种类 C 分子间隔
(2)MOF-801使用的原料中含有_____种元素。
(3)科学家研发的“集水神器”能够“吸汽”的原因是_____。
(4)工业电解氯化钠和水的溶液获得烧碱的化学方程式为_____。
(5)下列说法正确的是_____(填序号)。
A人工降雨可以缓解淡水危机
B 图3海水淡化过程中不涉及化学变化
C 北京是所列地区中缺水最严重的地区
D 与MOF-801相比,MOF-303应用前景更好
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我们的祖先创造了辉煌的古代文明,在对金属的运用和金属冶炼上也作出了巨大的成就.如我国是现代湿法冶金术的先驱,早在西汉时期刘安在《淮南万毕术》中写到“曾青得铁则化为铜”,符合这句话的化学方程式是( )
A.Zn+CuSO4=Cu+ZnSO4
B.Fe+CuSO4=Cu+FeSO4
C.Cu+2AgNO3=2Ag+Cu(NO3)2
D.CO+CuO![]() Cu+CO2
Cu+CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com