
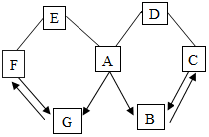
 如图所示A~G是初中化学中常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A时人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物,D为红色粉末.请回答:
如图所示A~G是初中化学中常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A时人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物,D为红色粉末.请回答:分析 根据题意,“A是人体胃液中含有的酸”,可确定物质A为盐酸;根据“G是最轻的气体”,可确定物质G为氢气;由此作为推断的出发点,结合题中对“B、C、D、E、F都是氧化物”“D为红色粉末”的限制条件及图中所示物质A~G是初中化学常见的物质,利用氧化物B物质可由盐酸生成可分析该物质为二氧化碳,把握物质F与G、B与C物质可以相互转化的特点等,完成对框图中所涉及物质的推断.
解答 解:根据“A是人体胃液中含有的酸”,可确定物质A为盐酸;根据“G是最轻的气体”,可确定物质G为氢气;由此作为推断的出发点,结合题中对“B、C、D、E、F都是氧化物”“D为红色粉末”的限制条件及图中所示物质A~G是初中化学常见的物质,利用氧化物B物质可由盐酸生成可分析该物质为二氧化碳,把握物质F与G、B与C物质可以相互转化的特点等,则C为一氧化碳,D为氧化铁,E为氧化钙,F为水,
代入检验.
(1)结合图框,根据分析,物质F为由氢气反应生成的氧化物且又可生成氢气,可判断F为水;与水和盐酸A都可以反应的氧化物E为可溶性碱反对应的金属氧化物,常见的此类物质为生石灰氧化钙,则可判断物质E为氧化钙,物质C为一氧化碳,故答案为:CO2;CaO+H2O═Ca(OH)2;作燃料(或冶炼金属);
(2)结合图框,能与A物质反应,可判断红色粉末物质D为常见的金属氧化物,如氧化铁;故A、D发生反应为稀盐酸与氧化铁等反应,其化学方程式为Fe2O3+6HCl═2FeCl3+3H2O;
故答案为:
(1)CO2;CaO+H2O═Ca(OH)2;作燃料(或冶炼金属);(2)Fe2O3+6HCl═2FeCl3+3H2O等.
点评 利用题目明确的物质氢气及盐酸,分析得出气体二氧化碳是解决本题物质推断的突破口;熟练掌握物质的性质及转化规律则是此类问题解决的基础.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:初中化学 来源: 题型:选择题
| A.化学常识 | B.化学与安全 |
| 空气的主要成分--氮气和氧气 硬水和软水--用肥皂水来检验 | 居室装修--常开窗通风,使有害物挥发 煤气泄漏--关闭气阀、打开排气扇电源开关 |
| C.化学与材料 | D.化学与环境 |
| 不锈钢汤勺--合金 聚乙烯塑料--有机合成材料 | 减少水污染--合理使用农药化肥 减少酸雨的发生--使用新型能源 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
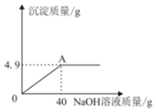 向160g硫酸铜溶液中,逐滴加入50gNaOH溶液,完全反应,生成4.9g沉淀,回答下列有关问题:(相对原子质量:Cu-64)
向160g硫酸铜溶液中,逐滴加入50gNaOH溶液,完全反应,生成4.9g沉淀,回答下列有关问题:(相对原子质量:Cu-64)查看答案和解析>>
科目:初中化学 来源: 题型:计算题

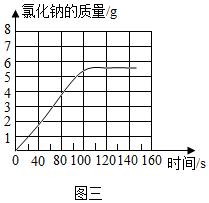 .
.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青蒿素属于无机物 | |
| B. | 青蒿素的相对分子质量为282g | |
| C. | 青蒿素中含有42个原子 | |
| D. | 青蒿素中碳元素的质量分数约为63.8% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com