
【题目】老师带领同学们探究铝和稀盐酸、稀硫酸的反应时发现:铝和稀盐酸剧烈反应,而和稀硫酸几乎不反应。
写出铝和稀盐酸反应的化学方程式_____。
[提出问题]铝和稀硫酸为什么几乎不反应?
[猜想与假设]猜想1:稀盐酸和稀硫酸中的氢离子浓度不同;
猜想2:盐酸中的氯离子对反应起了促进作用;
猜想3:硫酸中的硫酸根离子对反应起了阻碍作用。
[进行实验]
实验序号 | 实验操作 | 实验现象 | 实验结论 |
① | _____ | _____ | 猜想1错误 |
② | 在两支试管中各加入5 mL氢离子浓度相等的稀硫酸,分别插入规格相同的打磨的铝丝。 向其中一支试管中加入1g NaCl晶体 | _____ | 猜想2正确; 猜想3错误 |
[实验反思]
有同学用浓盐酸代替氯化钠证明猜想2正确,他的错误之处是_____。
[实验解释]老师带领同学们利用数字化手持技术探究金属铝和稀盐酸反应时容器内压强和温度随时间变化的关系(如图)。
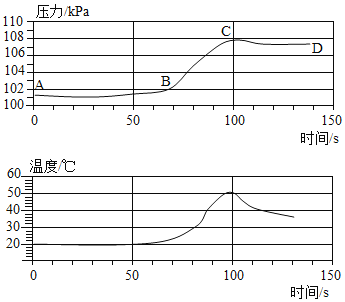
由图可知,_____(填字母序号)点时铝和稀盐酸反应完全。
(1) 0~50s内AB段压强变化不明显,原因可能是_____。
(2) BC段压强明显上升的主要原因是_____。
(3) CD段压强下降的原因是_____。
【答案】![]() 在两支试管中各加入体积相同,氢离子浓度不相等的稀硫酸,分别插入规格相同的打磨的铝丝 铝和不同浓度稀硫酸均几乎不反应(合理即可) 加入NaCl晶体的稀硫酸中反应剧烈,未加入的几乎不反应 将导致两组实验中氢离子的浓度差别较大,不能排除氢离子浓度对反应快慢的干扰 C 铝和空气中的氧气反应会生成氧化铝薄膜,盐酸会先与氧化铝反应生成氯化铝和水 铝和稀盐酸反应生成大量的氢气 反应结束后,随着热量的散失,压强逐渐变小(合理即可)
在两支试管中各加入体积相同,氢离子浓度不相等的稀硫酸,分别插入规格相同的打磨的铝丝 铝和不同浓度稀硫酸均几乎不反应(合理即可) 加入NaCl晶体的稀硫酸中反应剧烈,未加入的几乎不反应 将导致两组实验中氢离子的浓度差别较大,不能排除氢离子浓度对反应快慢的干扰 C 铝和空气中的氧气反应会生成氧化铝薄膜,盐酸会先与氧化铝反应生成氯化铝和水 铝和稀盐酸反应生成大量的氢气 反应结束后,随着热量的散失,压强逐渐变小(合理即可)
【解析】
铝和稀盐酸反应生成氯化铝和氢气,该反应的化学方程式为:![]() ;
;
进行实验:①实验结论为:猜想1错误,故实验应验证不同浓度的稀硫酸与铝反应,实验步骤:在两支试管中各加入体积相同,氢离子浓度不相等的稀硫酸,分别插入规格相同的打磨的铝丝,实验现象:铝和不同浓度稀硫酸均几乎不反应,可说明猜想1错误;
②实验结论为:猜想2正确,猜想3错误,实验步骤:在两支试管中各加入5 mL氢离子浓度相等的稀硫酸,分别插入规格相同的打磨的铝丝。 向其中一支试管中加入1g NaCl晶体,猜想2正确,猜想3错误,说明氯离子对反应起了促进作用,故实验现象为:加入NaCl晶体的稀硫酸中反应剧烈,未加入的几乎不反应;
实验反思:用浓盐酸代替氯化钠,将导致两组实验中氢离子的浓度差别较大,不能排除氢离子浓度对反应快慢的干扰;
实验解释:由图可知,C点时,压强最大,温度达到最高值,故C点时铝和稀盐酸反应完全;
(1)0~50s内AB段压强变化不明显,原因可能是:铝和空气中的氧气反应会生成氧化铝薄膜,盐酸会先与氧化铝反应生成氯化铝和水;
(2)BC段压强明显上升的主要原因是:铝和稀盐酸反应生成氢气,使压强增大;
(3)CD段压强下降的原因是:铝与稀盐酸反应放热,反应结束后,随着热量的散失,压强逐渐变小。


科目:初中化学 来源: 题型:
【题目】儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明书的部分信息,回答下列问题:

(1)葡萄糖酸锌由 种元素组成;
(2)葡萄糖酸锌中碳、氢元素的质量比为 ;
(3)要满足儿童身体正常的需要,在某一时间段需要适量补锌。若儿童1千克体重每日需要0.5毫克锌,每天从食物中只能摄入所需锌的一半。体重为20千克的儿童,理论上一天还需服该口服液多少支?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】大雨之后,某兴趣小组同学从綦江河中取出浑浊水样进行如下探究实验。
(1)要使浑浊水样变澄清,他们的净水方法是_____________(填名称)。
(2)向(1)所得水样中加入一定量肥皂水,振荡,观察到泡沫较少,浮渣较多,则 证明该水样属于_________(选填“硬水”或“软水”)。
(3)在实验室里,将(1)所得的水样变成纯净物的操作是_____(填名称)。
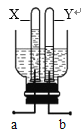
(4)利用自制装置对(3)所得的水进行电解实验,通电一段时间后,实验现象如图所示,Y 管内气体为_________,a 连接电源的______________极(选填“正”或“负”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文
纯净的臭氧(O3)在常温下是天蓝色的气体,有难闻的鱼腥臭味,不稳定,易转化为氧气。 它虽然是空气质量播报中提及的大气污染物,但臭氧层中的臭氧能吸收紫外线,保护 地面生物不受伤害。而且近年来臭氧的应用发展较快,很受人们的重视。生产中大量使用的臭氧通常由以下方法制得。
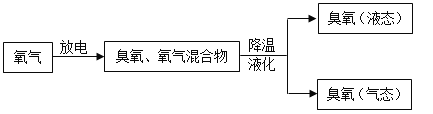
臭氧处理饮用水。早在 19 世纪中期的欧洲,臭氧已被用于饮用水处理。由于臭氧有强氧化性,可以与水中的有害化合物(如硫化铅)发生反应,处理效果好,不会产生异味。臭氧做漂白剂。许多有机色素的分子遇臭氧后会被破坏,成为无色物质。因此,臭氧可作为漂白剂,用来漂白麻、棉、纸张等。实践证明,臭氧的漂白作用是氯气的 15 倍之多。臭氧用于医用消毒。与传统的消毒剂氯气相比,臭氧有许多优点,如表 1 所示。
表 1臭氧和氯气的消毒情况对比
消毒效果 | 消毒所需时间(0.2mg/L) | 二次污染 | 投资成本 | |
臭氧 | 可杀灭一切微生物,包括细菌、病毒、芽孢等 | <5min | 臭氧很快转化为氧气,无二次污染,高效环保 | 约45万元 |
氯气 | 能杀灭除芽孢以外的大多数微生物,对病毒作用弱 | >30min | 刺激皮肤,有难闻气味,对人体有害,有二次污染、残留,用后需大量水冲洗 | 约3~4万元 |
依据文章内容回答下列问题:
(1)写出臭氧的一点物理性质_________。
(2)处理饮用水利用了臭氧的_____(填”物理”或”化学”)性质。
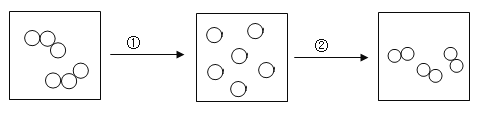
(3)臭氧转化为氧气的微观示意图如下图所示,其反应的微观实质是①_____,②______。
(4)为了快速杀灭病毒,应选择的消毒剂是_____。
(5)下列关于臭氧的说法中,正确的是_____。
A臭氧的漂白作用比氯气强
B由氧气制得臭氧的过程中,既有物理变化也有化学变化
C臭氧稳定性差,不利于储存,其应用可能会受到限制
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】芯片是内含集成电路的硅片,如图是硅元素在元素周期表中的相关信息,下列说法不正确的是
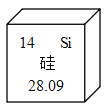
A.硅元素的原子序数为14
B.硅原子核内中子数可能为14
C.硅的相对原子质量为28.09
D.硅元素属于金属元素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】品味馒头中的化学
山西是面食的王国。发面馒头是山西人餐桌上不可缺少的一道美食。制作馒头的面粉是由小麦经筛选清洗后研磨而成的,其主要成分是淀粉(C6H10O5)n )。
制作馒头首先要发面,过去,人们用“老面”当“起子”,让面团发酵,由于“老面”中同时含有乳酸菌,乳酸菌在发酵过程中会产生有酸味的乳酸,加入适量的碱面可除去酸味,使馒头酥松多孔。乳酸具有酸的通性。有时候,人们也用小苏打作发酵粉,小苏打受热易分解生成碳酸钠、水和二氧化碳,使用时可在小苏打中加入一定量的食酷,这样蒸出的馒头不仅暄软,而且碱味还不大。
现在人们大多用酵母菌发酵,当面团中缺乏氧气时,酵母茵通过将葡萄糖转化成为二氧化碳和乙醇来获取能量,化学方程式为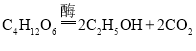 ,产生的二氧化碳将面团发起,而酒精则挥发。在有氧气的环境中,在酶的催化作用下,酵母菌将葡萄糖转化为水和二氧化碳、酵母菌最适宜生长的温度范围是20-~30°C,温度达到60°C时酵母菌死亡。酵母细胞中含有碳、氢、氧、磷、钙、铁、铜、锌、钴等元素。
,产生的二氧化碳将面团发起,而酒精则挥发。在有氧气的环境中,在酶的催化作用下,酵母菌将葡萄糖转化为水和二氧化碳、酵母菌最适宜生长的温度范围是20-~30°C,温度达到60°C时酵母菌死亡。酵母细胞中含有碳、氢、氧、磷、钙、铁、铜、锌、钴等元素。
我们在吃馒头时,少量的淀粉在咀嚼过程中被口腔中的淀粉酶催化,从而发生水解反应,生成麦芽糖(C12H22O11), 大部分的淀粉和麦芽糖进入小肠后,被彻底消化为能被人体吸收的葡萄糖。
小麦中含有较为丰富的B族维生素,B族维生素在酸性溶液中很稳定,即使加热也不会分解。而在碱性环境中很容易被分解破坏,即使温度不是太高也是如此。B族维生素还怕高温,怕漂白粉、氯气、二氧化硫和双氧水等物质,而且还容易在淘米、洗淀粉的过程中溶在水里流失掉。B族维生素有助您保持旺盛的精力和昂扬的情绪。
根据短文回答问题:
(1)向“老面”发好的面团中加入碱面,发生反应的微观实质是____________。
(2)用小苏打做发酵粉,蒸出的馒头暄软多孔的原因是____________________。
(3)用酵母菌发酵时,应将面团放在____________的环境中,酵母菌有氧呼吸时发生反应的化学方程式是_____________。写出酵母菌中含有的人体必需的一种微量元素____________。
(4)下列说法正确的是_______________。
A 人体摄人淀粉后主要在胃里被消化
B 用酵母菌发酵制作馒头时,不需要加碱面
C 二氧化硫漂白馒头,不会影响健康
D 长期食用加入大量碱面的馒头,人体会缺乏B族维生素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】25°C时,向25.0mL质量分数为30%的盐酸中滴加氢氧化钠溶液,溶液的pH与所加氢氧化钠溶液的体积如图所示。下列说法正确的是
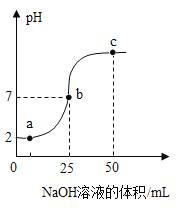
A.a点所示的溶液中含有的溶质是NaOH和NaCl
B.b点所示的溶液能使紫色石蕊溶液变红
C.所用氢氧化钠溶液的质量分数一定为30%
D.a、b、c所示的溶液中都含有Na+、Cl-
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合图示实验装置,回答下列问题。
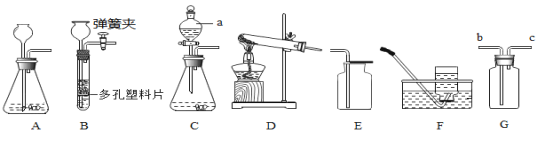
(1)写出图中标号仪器的名称:a____________________。
(2)实验室用氯酸钾和二氧化锰混合加热制氧气的化学方程式为____________________。反应后的二氧化锰可以熏复使用,为了从反应后的剩余物中回收纯净的二氧化锰,实验操作为溶解、过滤、________、干燥。
(3)实验室制取氢气时,选用B为发生装置的主要优点是___________________。
(4)若用C作为制取二氧化碳的发生装置,打开如图装置中分液漏斗的活塞后, 水不能滴下,该同学认为整套装置不漏气,你认为他的判断__________(填“正确 ”或“不正确”)。实验室为了除去其中的氯化氢气体,并将剩余气体收集在集气瓶中, 下列装置中最为合理的是____________________装置(填序号),试剂瓶中盛放的是____________________浓溶液。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包固体,可能含有NaCl、NaOH、Na2CO3、Na2SO4、MgCl2中的一种或几种。为确定其组成,取2g固体加足量水溶解得到无色溶液M,进行下图实验。
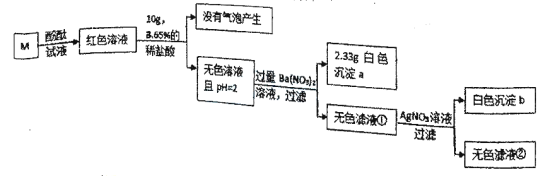
下列说法错误的是( )
A. 白色沉淀a是BaSO4,白色沉淀b是AgCl
B. 可以利用无色滤液检验长期敞口放置的氢氧化钠变质程度
C. 无色滤液②中的阳离子至少有3种
D. 该固体中一定有NaOH、Na2SO4,可能有NaCl,一定没有Na2CO3、MgCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com