质量相同的镁、铁、锌分别跟足量的盐酸充分反应,生成气体的质量由大到小的顺序是( )
A.镁、铁、锌
B.铁、镁、锌
C.锌、铁、镁
D.镁、锌、铁
【答案】
分析:根据选项中元素的相对原子质量和它们与稀盐酸反应的化学方程式,计算出1g这些金属分别与足量稀盐酸反应生成氢气的质量,再进行比较即可
解答:解:根据化学方程式:Mg+2HCl═MgCl
2+H
2↑;Zn+2HCl═ZnCl
2+H
2↑;Fe+2HCl═FeCl
2+H
2↑
可以看出:Mg的相对原子质量为24,24g镁可反应生成2g氢气,即1g镁生成
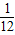
克氢气.
Zn的相对原子质量为65,65g锌可反应生成2g氢气,即1g锌生成
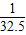
克氢气.
铁的相对原子质量56,56g铁可反应生成2g氢气,即1g铁生成
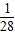
g氢气.
因为
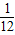
>
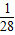
>

所以生成气体的质量由大到小的顺序是:镁>铁>锌;
故选A.
点评:本题主要考查学生运用化学方程式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力;

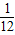 克氢气.
克氢气.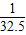 克氢气.
克氢气.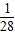 g氢气.
g氢气.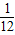 >
>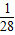 >
>


 春雨教育同步作文系列答案
春雨教育同步作文系列答案