30、Fe(OH)
3是一种红褐色沉淀,Fe(OH)
2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl
3+3NaOH═Fe(OH)
3↓+3NaCl.由于Fe(OH)
2不稳定,在水中只要有一点氧气就极易发生反应生成Fe(OH)
3,写出其反应的化学方程式:
4Fe(OH)2+2H2O+O2═4Fe(OH)3
,因而在溶液中较难制得纯净的Fe(OH)
2.
【猜想与假设】
若按照常规的正确方法向FeCl
2溶液中滴加NaOH溶液,很难观察到白色沉淀现象,只能看到灰绿色沉淀.你认为灰绿色沉淀最可能的成分是
Fe(OH)2和Fe(OH)3的混合物
.
【设计与实验】
用下面两种精心设计的方法可以制得白色的Fe(OH)
2沉淀.
方法一:用不含氧气的蒸馏水配置FeSO
4溶液与氢氧化钠溶液,然后反应制备.
(1)除去蒸馏水中溶解的氧气,常采用
煮沸
的方法.
(2)先在试管中注入FeSO
4溶液后,还要在试管中滴入
植物油
,然后再考虑加入NaOH溶液,实验更容易获得成功.
(3)生成白色沉淀的操作是用长滴管吸取不含O
2的NaOH溶液,插入FeSO
4溶液液面下,再挤出NaOH溶液,这样操作的理由是
防止氧气进入溶液
.
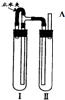
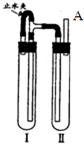
方法二:用右图装置来制备.
(1)在装置Ι中加入Fe和稀H
2SO
4.
(2)在装置Ⅱ中加入NaOH浓溶液.
(3)为了制得白色Fe(OH)
2沉淀,在装置Ι和Ⅱ中加入试剂,打开止水夹,塞紧橡胶塞,反应一段时间后再夹紧止水夹,

在夹紧止水夹之前的实验步骤是
在A处收集氢气进行验纯
,写出夹紧止水夹后Ⅱ中的化学反应方程式
H2SO4+2NaOH=Na2SO4+H2O
、
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
.
(4)这样生成的Fe(OH)
2沉淀能较长时间保持白色,其原因是
隔绝了氧气
.
【分析与计算】
将18gFe(OH)
2在空气中高温加热到质量不再变化为止,最终得到16g只含有Fe、O元素的剩余固体,请你通过计算来确认该固体的化学式.
【反思与应用】
(1)在化学实验中对于滴管到底能否伸入容器口内部去滴液体你的看法是
如果是滴瓶上的专用滴管不可以,若是另取的滴管则可以
.
(2)请你提出一个有关化学的常规情况下认为不可以,但改变了条件后却可以打破常规的例子
在实验室中鉴别食盐和蔗糖时不能用品尝的方法;在家中的厨房中就可以用品尝的方法来鉴别.
.

 在夹紧止水夹之前的实验步骤是
在夹紧止水夹之前的实验步骤是

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 28、Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH-A↓+NaCl,则A沉淀是
28、Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得,比如:FeCl3+NaOH-A↓+NaCl,则A沉淀是