
| A. | K2MnO4、KMnO4、MnO2三者中Mn元素的化合价逐渐升高 | |
| B. | FeO、Fe2O3、Fe3O4 三者含氧的质量分数逐渐增大 | |
| C. | NH4NO3、NaCl、CaO三者溶于水后,所得溶液的温度逐渐升高 | |
| D. | NaCl、Na2CO3、NaOH三者饱和溶液的pH逐渐变大 |
分析 A、根据在化合物中正负化合价代数和为零进行分析;
B、如果直接计算,那么计算量会非常的大,这三种物质都是由铁元素和氧元素组成的,故我们可以通过原子个数比来解决;
C、根据物质溶于水溶液的温度变化情况分析;
D、根据NaCl、Na2CO3、NaOH三者饱和溶液的pH分析.
解答 解:A、根据在化合物中正负化合价代数和为零,KMnO4中Mn元素的化合价为:(+1)+a+(-2)×4,则a=+7;K2MnO4中Mn元素的化合价为:(+1)×2+b(-2)×4=0,则b=+6;MnO2中Mn元素的化合价为:c+(-2)×2=0,则c=+4;故错误;
B、FeO中铁原子和氧原子的个数比为:Fe:O═1:1;Fe2O3中铁原子和氧原子的个数比为:Fe:O═2:3;Fe3O4中铁原子和氧原子的个数比为:Fe:O═3:4;原子个数比值最高的其中含铁元素的质量分数也就是最高的,故错误;
C、NH4NO3溶于水温度降低,NaCl溶于水溶液温度不变,CaO溶于水与水反应放热,温度升高,三者溶于水后,所得溶液的温度逐渐升高,故正确;
D、NaCl、Na2CO3、NaOH三者饱和溶液的pH分别是7、大于7、大于7,其中后两者由于没有指明温度,因此pH无法判断,故错误.
故选C.
点评 本题难度不大,掌握元素化合价的计算方法、元素的质量分数、物质溶于水后温度变化情况以及溶液的pH值等是解决此题的关键.


 天天向上口算本系列答案
天天向上口算本系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
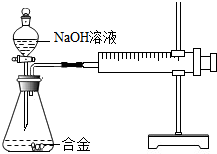 合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.| 实验步骤 | 实验现象 | 结论 |
| ①取一定量的合金粉末,加过量的30%氢氧化钠溶液,充分反应后过滤,滤渣备用 | 粉末部分溶解,并有无色气体放出 | 合金中一定含有铝 |
| ②取步骤①所得滤渣,加过量20%的硫酸溶液,充分反应 | 滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 | 合金中一定含有铁、铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 |
| ①称取上述固体样品8g溶于100mL水配成溶液,向溶液中滴加 过量的氯化钙溶液充分反应后,静置. | 产生白色沉淀 | 说明久置固体中,一定含有Na2CO3 |
| ②用玻璃棒蘸取少量①中的上层清液滴在pH试纸上,与标准比色卡对比,测出pH | pH=10 | 说明固体中,还一定含有NaOH(填化学式). |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
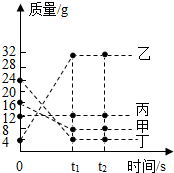 在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示.下列说法中不正确的是( )
在一密闭容器中加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,测得反应前及t1、t2时各物质质量如图所示.下列说法中不正确的是( )| A. | 乙物质一定是化合物 | |
| B. | 丙可能为该反应的催化剂 | |
| C. | 该反应中,乙、丁的质量变化之比为7:5 | |
| D. | 该反应中,甲、乙的质量变化之比为1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com