
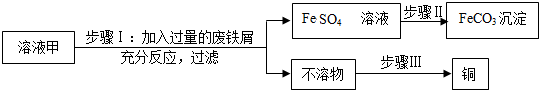
分析 (1)根据溶液甲中的溶质为Fe2(SO4)3、CuSO4及H2SO4,铁和硫酸铜反应生成硫酸亚铁和铜进行分析;根据铁锈和硫酸反应生成硫酸铁和水,硫酸铁和铁会生成硫酸亚铁进行分析;
(2)根据碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是碳酸钠进行分析;
(3)根据不溶物中含有置换出的铜和反应剩余的铁进行分析;
(4)黄铁矿中铁的含量最低,同时会生成SO2等有害气体污染环境.
解答 解:(1)溶液甲中含有硫酸铜,硫酸铜和加入的铁屑反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4;步骤Ⅰ中,废铁屑含有少量铁锈,对产物的成分没有影响,原因是铁锈与硫酸反应生成硫酸铁,硫酸铁和铁会生成硫酸亚铁;故填:Fe+CuSO4=Cu+FeSO4;铁锈与硫酸反应生成硫酸铁;
(2)碳酸亚铁是沉淀,硫酸亚铁经过步骤Ⅱ生成了碳酸亚铁,所以该试剂可以是碳酸钠;故填:Na2CO3;
(3)通过推导可知,不溶物中含有置换出的铜和反应剩余的铁,所以步骤Ⅲ回收铜的方法为:加入过量的稀硫酸,过滤、洗涤、干燥.故填:加入过量的稀硫酸,过滤、洗涤、干燥;
(4)黄铜矿的主要成分是CuFeS2,它不太适合炼铁,其原因是因为黄铜矿中铁的含量最低,同时会生成SO2等有害气体污染环境.故填:含铁量低(或其他合理答案).
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的知识进行解答.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:初中化学 来源: 题型:解答题
 不同年龄段的群体每天钙的适宜摄入量不同,哺乳期妇女每日推荐摄入量为1200mg.如图为某保健品说明书的一部分,请回答:
不同年龄段的群体每天钙的适宜摄入量不同,哺乳期妇女每日推荐摄入量为1200mg.如图为某保健品说明书的一部分,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物质 | 杂质 | 除杂所用的试剂和方法 | |
| A | Ca(OH)2固体 | CaCO3固体 | 加入适量的稀盐酸 |
| B | O2气体 | N2气体 | 通过灼热的Cu |
| C | MgCl2溶液 | NaCl溶液 | 先加入过量的NaOH溶液,再过滤 |
| D | H2气体 | HCl气体 | 先通过NaOH溶液,再通过浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
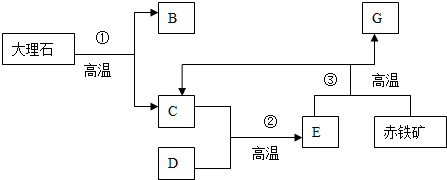
| A. | 些反应流程可降低碳的排放 | B. | G是单质铁 | ||
| C. | ③是置换反应 | D. | 本过程可循环使用的物质是C |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
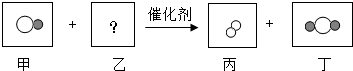
| A. | 该反应若无催化剂,则一定不能进行 | |
| B. | 乙的构成中含有 和 和 | |
| C. | 该反应前后原子的种类和数目一定不变 | |
| D. | 丁一定是氧化物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 碳酸钠溶液pH值测定(玻璃棒) | B. | 粗盐提纯(蒸发皿) | ||
| C. | 蒸馏自来水制蒸馏水(石棉网) | D. | 硝酸钾与食盐的分离(分液漏斗) |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 镁带燃烧后,生成物的质量比镁带质量增加了 | |
| B. | 3g碳与12g氧气充分反应,生成15g二氧化碳 | |
| C. | 20mL酒精与20mL水混合后,总体积小于40mL | |
| D. | 水变成水蒸气,质量不变,由此说明化学反应遵循质量守恒定律 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com