
| 加入稀盐酸次数 | 1 | 2 | 3 | 4 | 5 |
| 烧杯和烧杯内物质的总质量/g | 132.8 | 170.6 | 208.4 | 246.2 | 286.2 |
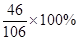 +(35g-21.2g-2.1g)×
+(35g-21.2g-2.1g)×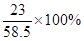 ]:(35g-21.2g-2.1g)×
]:(35g-21.2g-2.1g)×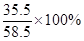 =138:71。
=138:71。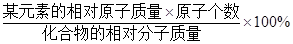 。
。

 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源:不详 题型:计算题
| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | 4.7g |
| 第二次加入10g | m g |
| 第三次加入10g | 2.1g |
| 第四次加入10g | 1.2g |
| 第五次加入10g | 1.2g |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
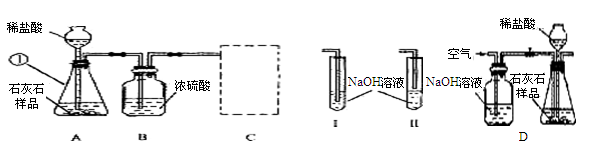
| 稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加入5g |
| 剩余固体的质量 | 3 | 2 | 1 | 1 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀硫酸的质量/g | 10 | 10 | 10 | 10 |
| 剩余固体的质量/g | 8.7 | 7.4 | 7 | 7 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
 ”分别表示氢和氧两种元素的原子。(已知氢、氧两种原子的相对原子质量分别为:H-1 O-16)
”分别表示氢和氧两种元素的原子。(已知氢、氧两种原子的相对原子质量分别为:H-1 O-16)| 分子 | 甲 | 乙 |
| 结构示意图 |  | 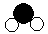 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
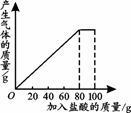
| 次数 | 1 | 2 | 3 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 30 | a | 20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com