
【题目】将一定量的镁粉和铁粉同时放入硝酸铜溶液中,充分反应后,过滤得滤渣和无色滤液。
(1)请写出一个该实验过程中发生反应的化学方程式_________ 。
(2)滤渣中一定含有哪种物质?__________
 应用题作业本系列答案
应用题作业本系列答案科目:初中化学 来源: 题型:
【题目】锶元素的粒子结构示意图和在元素周期表中显示的信息如下图所示:
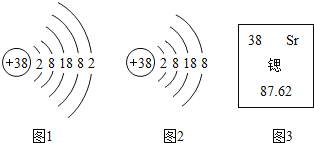
(1)锶元素的原子序数为________________;
(2)锶元素的相对原子质量为________________;
(3)图2所表示的粒子的化学符号是____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】华裔科学家高锟因提出“以高纯度的石英玻璃制造光纤”,获得2009年诺贝尔奖。从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料。回答问题:
(1)地壳里各种元素的含量(质量分数)如图所示,其中表示Si元素的含量为_____。
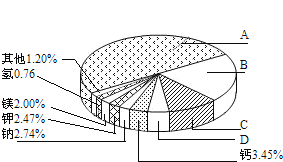
(2)根据元素周期表可知,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4。常温下,硅的化学性质______(填“活泼”或“不活泼”)。
(3)制备硅半导体材料必须先得到高纯硅,工业上以石英砂(主要成分SiO2)制取高纯度石英玻璃的生产原理如下。请回答:
![]()
![]()
①已知反应①的另一产物是有毒气体,其化学式为____,此副产物的用途是_______。
②已知反应②为化合反应,该反应的化学方程式为________________。
③反应③的化学方程式为SiCl4+O2![]() SiO2+2Cl2,该反应的基本类型为______。
SiO2+2Cl2,该反应的基本类型为______。
④将反应③中的氧气换成氢气,可制得生产计算机芯片的高纯硅,则另一产物的化学式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与生活、生产息息相关,请运用化学知识回答以下问题。
(1)电解水生成氢气和氧气说明______________。
(2)乙醇能作火锅燃料原因是_______________(用化学方程式表示)。
(3)只有单质生成的分解反应_______________(用化学方程式表示)。
(4)“氧来乐”可用于养殖池塘增氧,其主要成分为过氧化氢溶液,能增氧的原因是______________。(用化学方程式表示)
(5)有沉淀生成的复分解反应____________(用化学方程式表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高效的果蔬保鲜技术能解决鲜果长期保鲜的难题,提高水果的价值。在3℃、多湿的条件下,通过低压水银灯的照射,引起光化学反应,使水果贮存过程中,释放出的乙烯转变为乙醇,则回答:
(1)乙烯的化学式为C2H 4,常应用于促进农作物生长和果实催熟。下列说法不正确的是(_____)
A乙烯是一种有机物
B乙烯的相对分子质量为28
C乙烯中碳元素与氢元素的原子个数比为1:2
D乙烯中碳元素与氢元素的质量比为12:1:
(2)这种保鲜技术可以较长期保鲜的主要原因为____________,乙烯和水发生光化学反应生成乙醇,则化学方程式为____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用坐标系建立物质间的关系是总结化学知识的一种方法。A﹣M 是初中化学常见的九种物质,如图是根据这九种物质的类别和其中某种元素的化合价构建的它们之间的转化关系(图中“→”表示一种物质转换成另一种物质),已知 A 常用作食品干燥剂,E 和 D 是化学工业人们常说的“三酸两碱”中的“两碱”,G 是铁锈的主要成分。请回答下列问题:
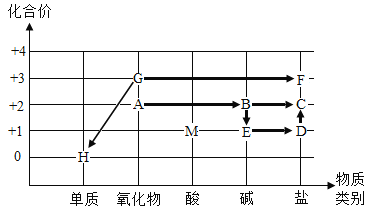
(1)写出 G 物质的化学式_____;
(2)A﹣H 八种物质中能与 M 溶液反应的物质有_____种,F 的水溶液呈_____色;
(3)写出 B→E 的化学方程式:_______________,该反应属于____________(填基本反应类型)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】每到冬天,市场上便有一种“热宝”出售,它是一个装有化学药品的小袋。使用时,撕去它的保护膜贴在身体上,不久便会产生热量。已知小袋中装有铁粉、碳粉和少量氯化钠。
(1)取小袋内物质,加入稀盐酸中,发生反应的化学方程式为:________。
(2)将袋内物质放在足量O2中燃烧,写出反应的化学方程式:
①____________________________、②________________。
(3)将袋内物质加入一定量的CuSO4溶液中,充分反应后过滤,滤液中的溶质一定有_____(填写化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】BaCl2是一种重金属盐,其水溶液具有很强的毒性。若误服了BaCl2溶液可立即服用MgSO4溶液解毒。为测定某BaCl2溶液的溶质质量分数,现取100克BaCl2溶液,不断加入MgSO4溶液,反应过程中溶液总质量与加入MgSO4溶液的质量关系如图所示,请回答:
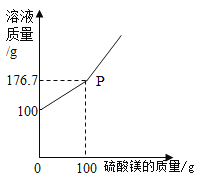
(1)P点时溶液中的溶质名称是 ;
(2)反应生成沉淀的最大质量为 克;
(3)求原BaCl2溶液的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学。发展“一碳化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。
(1)CO是从煤的气化或合成气得到的煤的气化主要反应有:
①2C+O2![]() 2CO;②C+H2O
2CO;②C+H2O![]() CO+H2;③CO+H2O
CO+H2;③CO+H2O![]() CO2+H2。
CO2+H2。
上述反应属于化合反应的是______(填序号),属于氧化反应的是______(填序号)。
(2)甲烷可制成合成气(CO、H2),再制成甲醇(CH3OH),代替日益供应紧张的燃油。由合成气制甲醇的反应方程式为:CO+2H2 CH3OH,由甲烷制成合成气有两种方法:
CH3OH,由甲烷制成合成气有两种方法:
①CH4+H2O CO+3H2 ②2CH4+O2
CO+3H2 ②2CH4+O2 2CO+4H2
2CO+4H2
从原料配比角度比较方法①和②,更适宜用于合成甲醇的方法是_____(填序号)。方法②发生反应的基本类型为_____。
(3)利用工业煤制重要的化工原料乙二醇,因具有低成本、低能耗、低排放等特点而具有非常广阔的前景,该制备过程如图所示:
![]()
则:从煤直接作燃料到用煤制取乙二醇,你得到的启示是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com