
【题目】有A、B、C、D四种可溶性化合物,分别由Ag+、Mg2+、Ba2+、Fe3+、Cl-、SO42-、NO3-、OH-八种离子中的一种阳离子和一种阴离子构成(每种离子只能选用一次)。将A、B、C、D的溶液两两混合,发生的现象为:A+B→白色沉淀;B+C→白色沉淀。根据题意请作答:

(1)写出下列物质的化学式:A____________,F中溶质___________。
(2)写出B与C反应的化学方程式:____________________________。
【答案】AgNO3 Fe(NO3)3 MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓
【解析】
根据“有A、B、C、D四种可溶性化合物,分别由Ag+、Mg2+、Ba2+、Fe3+、Cl-、SO42-、NO3-、OH-八种离子中的一种阳离子和一种阴离子构成”、“将A、B、C、D的溶液两两混合,发生的现象为:A+B→白色沉淀,B+C→白色沉淀”,结合图可知:有不溶于酸的硫酸钡或硝酸银沉淀,根据黄色溶液推测一定为含有铁离子的溶液,故推测:A为硝酸银、B为氯化镁、C为氢氧化钡、D为硫酸铁,E为硫酸钡,F为硝酸铁,代入检验,符合题意.
(1)根据分析,A为硝酸银,F为硝酸铁,则其化学式分别为:AgNO3,Fe(NO3)3;
(2)根据分析,B为氯化镁、C为氢氧化钡,则B与C反应的化学方程式为:MgCl2+Ba(OH)2═BaCl2+Mg(OH)2。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:初中化学 来源: 题型:
【题目】下图是a、b、c三物质的溶解度曲线,下列分析不正确的是( )
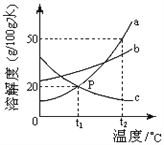
A. t2 ℃时a、b、c三种物质的溶解度由大到小的顺序是a﹥b﹥c
B. t2 ℃时,将50g a物质放入100g水中充分溶解得到a的饱和溶液(a物质不含结晶水)
C. 将c的饱和溶液变为不饱和溶液,可采用降温的方法
D. 将t2 ℃时a、b、c三种物质的饱和溶液降温至t1 ℃时,所得溶液的溶质质量分数关系是:b﹥a﹦c
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海洋是人类宝贵的自然资源,如图是利用海水“制碱”的部分流程。请完成下列问题:
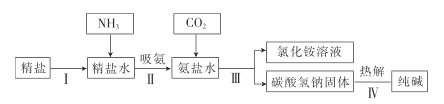
(查阅资料)
①在20℃时,1份体积的水可溶解700份体积的氨,溶液显碱性。
②在20℃时,1份体积的水可溶解约1份体积的二氧化碳,二氧化碳溶于水生成碳酸。
(1)步骤Ⅲ的反应原理是著名的“侯氏制碱法”的重要反应,依据质量守恒定律推断反应物是![]() 、____________(填化学式)。
、____________(填化学式)。
(2)步骤Ⅳ发生反应的化学方程式为__________________.
(3)工业上采用氨碱法生产纯碱的工艺是先向饱和食盐水中通人较多的![]() ,再通入足量的
,再通入足量的![]() ,其原因是_______________(填字母)。
,其原因是_______________(填字母)。
A![]() 比
比![]() 更易制取
更易制取
B![]() 的密度比
的密度比![]() 大
大
C使![]() 更易被吸收
更易被吸收
D为了增大![]() 的溶解度
的溶解度
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是表示在9.8g 10%的稀H2SO4中逐滴滴入10%的Ba(OH)2溶液的变化过程。下列说法正确的是( )
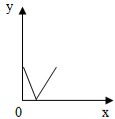
A.X是时间,Y是pH
B.X是水的总质量,Y是H2SO4的质量
C.X是加入Ba(OH)2溶液的质量,Y是沉淀物质的质量
D.X是加入Ba(OH)2溶液的质量,Y是溶液中溶质的质量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某反应的微观示意图。下列说法正确的是
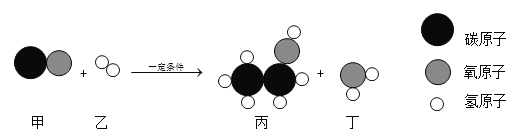
A. 物质丙由2个碳原子、1个氧原子和6个氢原子构成
B. 该反应的反应物和生成物中共有3种氧化物
C. 参加反应的甲、乙分子个数比为1:2
D. 该反应属于置换反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上常采用“双碱法”除去烟气中的![]() ,工业流程示意图如下.
,工业流程示意图如下.
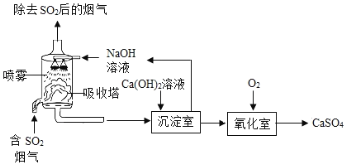
(1)吸收塔中,用NaOH溶液吸收![]() ,化学反应方程式是___.NaOH溶液喷成雾状能充分吸收SO2的原因是_____
,化学反应方程式是___.NaOH溶液喷成雾状能充分吸收SO2的原因是_____
(2)氧化室中,化学反应方程式是_______。
(3)已知部分原料的价格如表所示.
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.90 |
上述工业流程中,处理相同量的![]() ,双碱法所需的原料成本比用NaOH直接吸收更低,原因是___
,双碱法所需的原料成本比用NaOH直接吸收更低,原因是___
(4)某中学化学兴趣小组为测定工厂周围的空气中的二氧化硫含量是否符合国家标准,将![]() 周围空气通入一定含量碘(
周围空气通入一定含量碘(![]() )2.54mg的碘水中,经测定I2与二氧化硫恰好完全反应,该反应的化学方程式是
)2.54mg的碘水中,经测定I2与二氧化硫恰好完全反应,该反应的化学方程式是![]() 。通过计算说明此烟气排放后周围空气中二氧化硫的浓度级别______。
。通过计算说明此烟气排放后周围空气中二氧化硫的浓度级别______。
[资料信息:我国空气质量标准对空气中二氧化硫的浓度级别规定如下表所示(空气中二氧化硫的浓度用单位体积的空气中所含二氧化硫的质量表示)]。
浓度级别 | 标准(mg·m-3) |
一级 | 浓度≤0.15 |
二级 | 0.15<浓度≤0.50 |
三级 | 0.50<浓度≤0.70 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】长沙市北雅中学初三化学兴趣小组对酸碱盐之间发生的复分解反应充满了无限的好奇,加之某些酸碱盐之间发生反应还能产生五彩缤纷的沉淀,如白色沉淀有CaCO3和BaSO4等,蓝色沉淀有Cu(OH)2,这些都引起他们强烈的探究欲望。请写出一个能够生成蓝色沉淀的复分解反应的化学方程式:①_________。
兴趣班指导老师金老师告诉他们:Fe(OH)3是一种红褐色沉淀,而Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得。但是由于Fe(OH)2很不稳定,在水溶液中只要有一点氧气就极易发生反应变成Fe(OH)3,因而要在溶液中制得纯净且稳定的Fe(OH)2是比较困难的。于是,在周未,兴趣班的同学积极探究如何制取纯净且稳定的Fe(OH)2:
实验活动一:
礼礼同学和婷婷同学合作探究,她们用滴管吸取NaOH溶液滴入氯化亚铁溶液中,观察到白色沉淀立即变为灰绿色沉淀,最后变成了红褐色沉淀。鹏鹏同学马上指出了她们失败的原因,你认为得不到稳定的白色沉淀的原因是②_______。
实验活动二:
松松同学和玲玲同学积极思考,精心设计了如图的实验装置,成功制得并观看到了白色的Fe(OH)2沉淀。已知他们用到的实验药品有:NaOH溶液、铁屑、稀H2SO4。
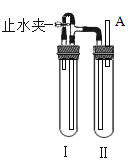
操作方法如下:
(1)在试管Ⅰ里应该加入的试剂是足量铁粉和适量稀硫酸,两者反应的化学方程式为③_______。
(2)在试管Ⅱ里应该加入的试剂是氢氧化钠溶液。
(3)为了制得Fe(OH)2白色沉淀,正确的操作顺序是④__________(填下列序号)。
A 检查装置气密性 B 检查试管Ⅱ出口A处排出的H2的纯度
C 夹紧止水夹 D 在试管Ⅰ和Ⅱ中加入试剂,塞紧塞子,打开止水夹
(4)这样试管Ⅱ中可以看到生成的Fe(OH)2沉淀能较长时间保持白色,其原因是⑤_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】味精是烹制菜肴时常用的调味品,如图是某品牌味精的包装说明。(假设味精中不含其它成分)小明研究某品牌味精包装上的部分文字说明后,想测定此味精中氯化钠的含量。
(实验过程)①称取该味精样品10.0g,并溶于蒸馏水。
②加入过量的硝酸银溶液,过滤。
③用蒸馏水反复洗涤沉淀多次。
④将沉淀烘干、称量,测得固体质量为5.74g。
(查阅资料)![]() ,谷氨酸钠的存在不影响氯化钠的性质。通过计算确定此样品中氯化钠的质量分数与其包装上的标注的含量是否相符。_______
,谷氨酸钠的存在不影响氯化钠的性质。通过计算确定此样品中氯化钠的质量分数与其包装上的标注的含量是否相符。_______
xx牌味精
主要成分:谷氟酸钠
特性:有鲜味,易溶于水
含量:谷氯酸钠≥80%
氯化钠≤20%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com