
【题目】A、B、C、D、E是初中常见的五种物质,其中 D是黑色固体,且与C在一定条件下反应有红色物质生成,E的固体俗称干冰.①、②、③、④的反应类型分别是复分解反应、分解反应、化合反应和置换反应.图中“一”表示两端物质间能发生反应,“→”表示物质间的转化关系,部分反应物、生成物及反应条件已略去.
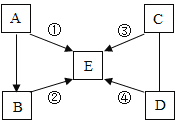
请回答下列问题:
(1)写出下列物质的化学式:
D_________ E_________
(2)写出下列反应的化学方程式:
①____________________ ④___________________.
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:初中化学 来源: 题型:
【题目】某研究性学习小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略).
查阅资料:CO2+Zn![]() CO+ZnO;FeCl3溶液遇KSCN溶液变红.
CO+ZnO;FeCl3溶液遇KSCN溶液变红.
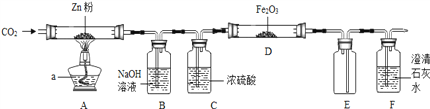
请回答下列问题:
将研究小组分为两组,按如图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D进行加热,其产物均为黑色粉末(纯净物).两组分别用产物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入盐酸 | 溶解,无气泡,溶液呈浅黄绿色(含两种金属离子) | 溶解,有气泡,溶液呈浅绿色 |
2 | 取步骤1所得溶液,滴加KSCN溶液 | 变红 | 无现象 |
(1)则乙组装置D玻璃管中反应的化学方程式是_________________________________,甲组得到的黑色粉末是______.
(2)从安全考虑,本实验应在装置_____和______之间再添加装置E防止倒吸.(填字母编号)
(3)该对比实验结果表明CO的还原能力随温度的升高而________(填“增强”或“减弱”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】波尔多液是一种运用广泛的农药,由熟石灰和硫酸铜配制而成。某工厂用以下反应:2Cu+O2+2H2SO4=2CuSO4+2H2O来生产硫酸铜,若要制得80kg 硫酸铜。试计算:
(1)硫酸铜中_______(填符号)元素的质量分数最小。
(2)若恰好消耗稀硫酸的质最是400kg,则该稀硫酸溶质的质量分数是多少?
(3)上述过程中,所得硫酸铜溶液中溶质的质量分数是多少?(计算结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化曲线如图所示。下列说法错误的是
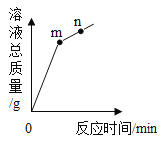
A. 该实验是将稀盐酸逐渐加入到盛有氧化铜的容器中
B. m点表示氧化铜与稀盐酸恰好完全反应
C. m点和n点对应溶液中铜元素的质量不相等
D. m点和n点对应溶液蒸发结晶后得到的固体成分相同
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(10分)南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源。
(1)海水制盐。从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质,为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发。正确的操作顺序是 (填字母)。加Na2CO3溶液的作用是除去 。
(2)海水淡化。下图是一个简易的蒸馏法淡化海水的装置。证明得到的水是淡水的方法是 。

(3)海水制镁。从海水中提取金属镁的过程如下图所示:

在上述转化过程中发生中和反应的是 (填反应顺序号)。海水中本身就含有氯化镁,则①、②两步的作用是 。
(4)海水“制碱”。氨碱法制纯碱是先通过化学反应生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3制得纯碱。
①氨碱法制纯碱中生成NaHCO3和NH4Cl的化学方程式为 ;
②反应中生成NaHCO3和NH4Cl的质量比为84∶53.5,NaHCO3和NH4Cl的溶解度曲线如图所示。请分析NaHCO3结晶析出而NH4Cl没有结晶析出的原因是 。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】漳州小吃手抓面,制作时要用发到大树碱,大树碱的主要成分是K2CO3.为了测定大树碱中K2CO3的质量分数,小文同学进行了如下实验;
(1)用托盘天平称取10g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是_________.

(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是_________.
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是_________.
(4)向配好的溶液中逐渐加入CaCl2溶液,生成1g沉淀(假设大树碱中其它成分不参与反应,反应的化学方程式为CaCl2+K2CO3═CaCO3↓+2KCl).计算大树碱中K2CO3的质量分数.
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K2CO3的质量分数_________ (填“偏大”或“偏小”)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学做了如下图所示实验:
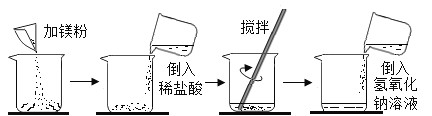
加入镁粉的质量 | m | m |
加入质量分数为14.6%稀盐酸的质量 | 50g | 100g |
加入氢氧化钠溶液的质量 | 100g | 100g |
加入氢氧化钠溶液后的实验现象 | 产生白色沉淀 | 无明显现象 |
第一次实验每步均恰好完全反应,请回答:
(1)写出第一次实验中发生反应的化学方程式:_____;
(2)第二次反应后溶液中溶质的组成是_____;
(3)每次实验加入镁的质量(m)为_____;
(4)求解第一次反应中生成气体的质量(X)的比例式为_____;
(5)若将第一次反应后溶液蒸发掉68.4 g水后,则所得不饱和溶液中溶质的质量分数是_____;
(6)若用36.5%的浓盐酸配制实验中所需稀盐酸,则需要加水的质量为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】天然海水呈弱碱性,利用海水脱硫是减少SO2排放的有效方法,其工艺流程如下图所示:
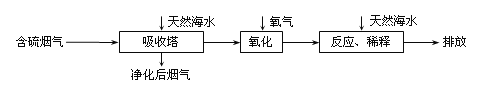
吸收了较多的含硫烟气后,有H2SO3生成,通入氧气发生化合反应后,海水的酸性显著增强。
①设计一种检验净化后的烟气中是否含SO2的简单的实验方案:____。
②用化学方程式表示海水酸性增强的原因____。
③氧化后的海水需要用大量的天然海水与之混合后才能排放,该操作的主要目的是____。
④某同学取一定量酸雨样品,加入含Ca(OH)2 7.4%的石灰浆吸收其中的SO2,恰好完全吸收时消耗石灰浆10.00g。则该酸雨样品中溶解SO2的质量为___克?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外活动小组同学用图中装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体)。实验过程如下:
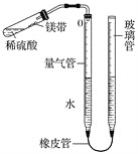
①取一段镁带样品,准确称得其质量为0.030 g;
②往量气管内装水至低于刻度“0”的位置,如图所示,(未装药品)装配好仪器;
③_________________________;
④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞;
⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置;
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应;
⑦待冷却至室温后,再次记录量气管中液面位置;
⑧算出量气管中增加的气体体积为23.96 mL;
已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。
请回答下列问题:
(1)写出镁与稀硫酸反应的化学方程式:____________________。
(2)能否用托盘天平称量0.030 g镁带样品________(填“能”或“不能”)。
(3)操作③是_________________________。
(4)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果________(填“是”或“否”),理由是_______________________。
(5)若实际测得氢气的体积与理论值相比偏大,则可能的原因是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com