
����Ŀ����Ȼ��ˮ�������ԣ����ú�ˮ�����Ǽ���SO2�ŷŵ���Ч�������乤����������ͼ��ʾ��
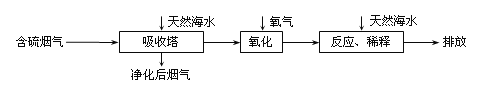
�����˽϶�ĺ�����������H2SO3���ɣ�ͨ�������������Ϸ�Ӧ��ˮ������������ǿ��
�����һ�ּ��龻������������Ƿ�SO2�ļ�ʵ�鷽����____��
���û�ѧ����ʽ��ʾ��ˮ������ǿ��ԭ��____��
��������ĺ�ˮ��Ҫ�ô�������Ȼ��ˮ��֮��Ϻ�����ŷţ��ò�������ҪĿ����____��
��ijͬѧȡһ����������Ʒ�����뺬Ca(OH)2 7.4%��ʯ�ҽ��������е�SO2��ǡ����ȫ����ʱ����ʯ�ҽ�10.00g�����������Ʒ���ܽ�SO2������Ϊ___�ˣ���д��������̣�
���𰸡��������������ͨ��Ʒ����Һ������Һ��ɫ�����к���SO2����֮���� ![]() ��
��![]() Ϊ�˽��ͺ�ˮ�����ԣ�������Ⱦ 0.64
Ϊ�˽��ͺ�ˮ�����ԣ�������Ⱦ 0.64
��������
�ٿ�����Ʒ����Һ�����飬����������������ͨ��Ʒ����Һ������Һ��ɫ�����к���SO2����֮���ޡ�
�ڸ������⣬��ˮ������ǿ���������˽϶�ĺ�����������H2SO3���ɣ�ͨ�������������Ϸ�Ӧ�����![]() ��
��![]() ��
��
��������ĺ�ˮ��Ҫ�ô�������Ȼ��ˮ��֮��Ϻ�����ŷţ��ò�������ҪĿ����Ϊ�˽��ͺ�ˮ�����ԣ�������Ⱦ�����Ϊ�˽��ͺ�ˮ�����ԣ�������Ⱦ��
�ܽ⣺����Ʒ���ܽ�SO2������Ϊx��
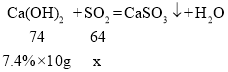
![]()
x=0.64g
�𣺸�������Ʒ���ܽ�SO2������Ϊ0.64�ˡ�


 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʵ������ȡ����IJ���װ����ͼ��ʾ����ش��������⡣
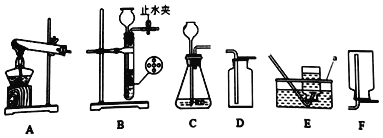
��1������a������_____��
��2��ʵ������ȡ������̼�Ļ�ѧ����ʽΪ_____����Dװ���ռ������壬��������Ϊ_____��
��3����ȡ����ǰҪ����װ�õ������ԣ�����Bװ�������Եķ���Ϊ_____��
��4��ʵ������ȡ�����Ļ�ѧ����ʽΪ_____�����Ʊ����ռ��Ƚϴ�������������ѡ�õ�װ����_____������ĸ����
��5��ʵ������H2O2��MnO2��ȡ������ԭ��Ϊ2H2O2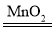 2H2O+O2��������㣺
2H2O+O2��������㣺
��H2O2����Է���������_____��
�����ռ�0.5L������ʵ���������������ܶ�Ϊ1.43gL��1������������_____g��
����ȡ����������Ҫ������������Ϊ5%��˫��ˮ��Һ_____g����ȷ��0.1g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E�dz��г������������ʣ����� D�Ǻ�ɫ���壬����C��һ�������·�Ӧ�к�ɫ�������ɣ�E�Ĺ����׳Ƹɱ������������������ķ�Ӧ���ͷֱ��Ǹ��ֽⷴӦ���ֽⷴӦ�����Ϸ�Ӧ���û���Ӧ��ͼ����һ����ʾ�������ʼ��ܷ�����Ӧ����������ʾ���ʼ��ת����ϵ�����ַ�Ӧ������P��Ӧ��������ȥ��
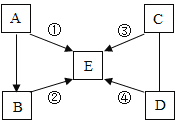
��ش��������⣺
��1��д���������ʵĻ�ѧʽ��
D_________ E_________
��2��д�����з�Ӧ�Ļ�ѧ����ʽ��
��____________________ ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǰ��˻����������������ʾ��ͼ��
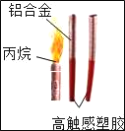
��1�������л��߷��Ӳ��ϵ���_____
��2�������Ͻ�������Ʋ��ϵ��ŵ���_____����һ�㣩
��3��ȼ���ñ��飨C3H8��Ϊʲô˵����������ɫ�������������_____
��4���ɼ�����ƥ��ʥ���Ψһ��ʽ�����ڰ���ƥ�˵ĺ�������ǰͨ��̫���⼯���ڰ��澵�����룬��ȼʥ�𣮴˹�������ؼ���ȼ��������_____��
��5���������˻�𩁾�����ÿСʱ65�����ǿ���ÿСʱ50��������������±���ȼ�գ���Ҫʵ�ְ���ʥ��Ƕ���壬����Ҫ�����ؼ���ȼ��������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ������ȷ��ӳ���Ӧ��ϵ����
A. ���������������������ϡ�����м���������þ����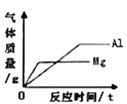
B. ��һ����ϡ����������ƵĻ��Һ�еμ��Ȼ�����Һ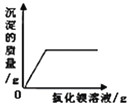
C. ��һ����������������Һ�еμ�pH=2��ϡ����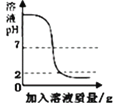
D. ������CaCO3�ֱ�������������������ϡ���ᣨ��������Ӧ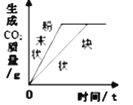
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ϡHCl��NaOH��Һ��Ӧ��pH�仯���ߣ�����˵����ȷ���ǣ�������
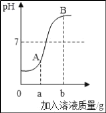
A. �÷�Ӧ��ϡHCl����NaOH��Һ��
B. ag��ָ�����������ƹ�������
C. A����Һ������ΪHCl��NaCl
D. ��B����Һ�еμ���ɫʯ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ļ��ȴ�������Ұ�����ʳ����ȴ��еĹ����ĩ��þ�ۡ����ۺ��Ȼ��ƣ�ʹ��ʱ�����м���ˮ���е�ˮ�����ɲ��������ȡ�ʵ��С����Է��ȹ����еķ�Ӧԭ��չ��̽����


���������ϡ�
������þ������ˮ�����û���Ӧ���ҷ��ȡ�
������ʵ�顿
ͬѧ������ͼ��ʾװ�ý���ģ��ʵ�飺�ֱ�ȡ��ͬ�ɷֵĹ����ĩ������У�ͨ����Һ©�������о�����8 mLˮ����ȡ�������ù�Һ����������¶ȣ�ʵ���¼���±���
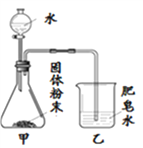
��ʵ��ʱ������Ϊ22.8�棩
ʵ����� | A | B | C | D | E | F |
����ɷ� | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
�������� | ���������ݣ����Ե�ȼ | ______ | ���������ݣ����Ե�ȼ | �϶�����ݣ���ȼ�б����� | ������ | ���������ݣ���ȼ�б����� |
������¶� | 23.1�� | 22.8�� | 23.1�� | 24.2�� | 22.8�� | 27.2�� |
����������ۡ�
��1��ʵ��B����������Ϊ_______________��
��2��ʵ��A֤����þ����ˮ�ܷ�Ӧ����ɸ÷�Ӧ�Ļ�ѧ����ʽMg+2H2O=____+H2 ![]() ��
��
��3��ʹþ����ˮѸ�ٷ�Ӧ�����ȵ���ѷ�������þ���м���_____________��
����˼�Ľ���
��4��ͬѧ�Ƿ���ʵ�����ݷ��֣����ߵ��¶�û�дﵽʳƷ���ȴ���Ч��������ܵ�ԭ����___________��
��5��ͬѧ�Ǹ���ʵ������һ���²⣬ʵ��F�еķ�Ӧ��������ʣ�������������Ȼ�������ۣ����������۴��ڵĵ�ʵ�鷽��Ϊ��ȡ������������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ����ɫ���壬���ܺ���Na2SO4��Na2CO3��BaCl2��NaOH�е�һ�ֻ��֡�ȡ������ˮ���а�ɫ�������������˺�������еμ����ᣬ����������������������������������Ĺ�ϵ����ͼ��ʾ��
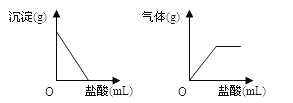
�ɴ��ƶϰ�ɫ������
A�����ܴ���NaOH
B�����ܴ���Na2SO4
C���϶�������BaCl2
D���϶�ֻ����Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ������©����A����©�£�A��F�ֱ����6�ֳ��л�ѧ�ij������ʣ�������ľ̿��̼��ij���������������������������ͭ��
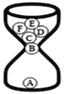
����©�µĹ�����Է��������ڶ���ĵ�һ��©�£�
����©�µ����Ӵ�����һ������ܷ�Ӧ������©�£��Ӷ�ʵ�ְ�A��B��C��D��E��F��˳��©�¡�
(1)������̼��ij�����������Ļ�ѧʽ��___��
(2)A��B��Ӧ��������____��
(3)����C����;��____��
(4)E��F������Ӧ�Ļ�ѧ����ʽ��____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com