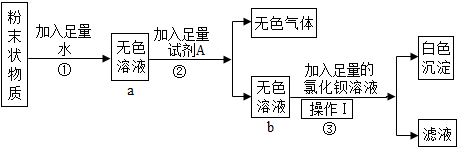
解答:解:(1)由图示可知,标号仪器的名称:①长颈漏斗;②集气瓶.
(2)实验室用大理石和稀盐酸反应制取二氧化碳,反应物的状是固体和液体,反应条件是常温,应选用发生装置B,由于二氧化碳的密度大于空气的密度,可选用收集装置D,反应的化学方程式为:CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑,检验集气瓶中CO
2是否收集满的方法是:将燃着的木条置于集气瓶口,若木条熄灭则证明收集满了;若用制取CO
2的发生装置制取氧气,根据装置的特点,应用过氧化氢在二氧化锰催化作用下制取氧气,其反应的化学方程式为:2H
2O
2 2H
2O+O
2↑.
(3)实验室用KMnO
4制取O
2时,属于加热固体制取氧气,可选用的发生装置是A,若同时用E装置收集O
2,实验停止时的操作顺序是:先把导管从水槽中移出,再熄灭酒精灯,其原因是:防止水槽中的水倒流入热的试管,引起试管的炸裂.
(4)若用装置C收集某气体,属于向下排空气法收集,该气体应具备的性质是:气体的密度小于空气的密度.
(5)若用F装置收集二氧化碳,由于二氧化碳的密度大于空气的密度,则气体应从a端通入;
①装置C中观察到得现象是:下面的蜡烛先熄灭,上面的蜡烛后熄灭;说明二氧化碳具有的性质是:不燃烧、不支持燃烧,密度比空气大.因此,二氧化碳可用于灭火.
②仅利用装置B中的现象不能说明二氧化碳与水反应.缺少对比试验,不能排除二氧化碳使紫色石蕊试液变成红色.
故答为:(1)①长颈漏斗,②集气瓶;(2)BD,CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑,将燃着的木条置于集气瓶口,若木条熄灭则证明收集满了,2H
2O
2 2H
2O+O
2↑;(3)A,先把导管从水槽中移出,再熄灭酒精灯,防止水槽中的水倒流入热的试管引起试管的炸裂;(4)气体的密度小于空气的密度;(5)a;①下面的蜡烛先熄灭,上面的蜡烛后熄灭;不燃烧、不支持燃烧;密度比空气大,灭火;②不能,缺少对比试验,不能排除二氧化碳使紫色石蕊试液变成红色




 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案