
����Ŀ���Ȼ�������������Ҫ�ĵ�ζƷ��Ҳ��һ����Ҫ�Ĺ�ҵԭ�ϣ� 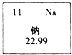
��1��ijƷ�Ƴ�֭��Ӫ���ɷ��к����ơ�17���ˣ���ͼ������Ԫ�����ڱ��е�һ�������жϲ���ȷ���� ��
A.�����ơ�17�����еġ��ơ���ָ��Ԫ��
B.һ����ԭ�Ӻ�����11������
C.��ԭ���ڻ�ѧ�仯�����õ���
D.�Ƶ����ԭ��������22.99
��2���Ȼ������˵�����������ز����ٵģ���������ˮ�д��ڵ������� ��
��3���ڹ�ҵ�Ͽ��õ�ⱥ�͵�ʳ��ˮ�ķ�������ȡ�ռͬʱ�ɵõ��������嵥�ʣ�����һ������������壬�÷�Ӧ�Ļ�ѧ����ʽ ��
��4����ҵ���ù�ҵʳ�Σ����Ȼ��ơ��Ȼ�þ���ʣ�Ϊԭ����ȡ�ռ���������£� 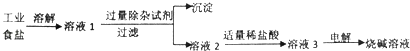
�ټ���ij����Լ�����
�ڼ�������ϡ�����Ŀ���� �� �ж�ϡ��������������������
���ܽ⡢���˲������õ��IJ��������� ��
��5���ø÷����õ����ռ��л����������Ȼ��ƣ�Ϊ�ⶨ�õ��ռ������������ȡ10g������Ʒ����ˮ�����Һ������5%������ͭ��Һ����ȫ��Ӧ���������ˡ�ϴ�ӡ�����õ�9.8g����������Ʒ���ռ������������
���𰸡�
��1��C
��2��Na+��Cl����H2O
��3��2NaCl+2H2O ![]() 2NaOH+H2��+Cl2��
2NaOH+H2��+Cl2��
��4��NaOH��Һ��Na2CO3��Һ����ȥNaOH��Na2CO3������������ð�����ձ��Ͳ�����
��5��
�⣺����Ʒ���ռ����������Ϊx��
2NaOH+CuSO4=Cu��OH��2��+Na2SO4
2��40 ��������98
10g��x ������9.8g
![]() ��ã�x=80%��
��ã�x=80%��
����������1��A�������ơ�17�����еġ��ơ���ָ��Ԫ�أ���A˵����ȷ��
B��һ����ԭ�Ӻ�����11�����ӣ���B˵����ȷ��
C����ԭ��������������1��С��4���ڻ�ѧ�仯������ʧȥ���ӣ���C˵������ȷ��
D���Ƶ����ԭ��������22.99����D˵����ȷ��
��2����������ˮ�д��ڵ�������Na+��Cl����H2O��
��3���ڹ�ҵ�Ͽ��õ�ⱥ�͵�ʳ��ˮ�ķ�������ȡ�ռͬʱ�ɵõ��������嵥�ʣ�����һ������������壬������������������������غ㶨�ɿ�֪����һ�ֵ�������Ϊ�������÷�Ӧ�Ļ�ѧ����ʽ��2NaCl+2H2O ![]() 2NaOH+H2��+Cl2����
2NaOH+H2��+Cl2����
��4�������ڹ�ҵ�Ȼ����к����Ȼ��ơ��Ȼ�þ���ʣ�Ϊ�˵õ��Ȼ��ƣ������ȼ����������Ƴ�ȥ�Ȼ�þ���ټ���̼���Ƴ�ȥ�Ȼ��ƣ����Գ��ӵ��Լ��ǣ�NaOH��Һ��Na2CO3��Һ����������Һ���м��������NaOH��Na2CO3 �� ���Լ�������ϡ�����Ŀ���ǣ���ȥNaOH��Na2CO3 �� ����ϡ������̼���Ʒ�Ӧ�����˶�����̼���壬���ԣ��ж�ϡ�����������������ǣ�����������ð�������ܽ⡢���˲������õ��IJ����������ձ��Ͳ�������
�ʴ�Ϊ����1��C����2��Na+��Cl����H2O����3��2NaCl+2H2O ![]() 2NaOH+H2��+Cl2������5����Ʒ���ռ����������Ϊ80%��
2NaOH+H2��+Cl2������5����Ʒ���ռ����������Ϊ80%��
�����㾫����������Ĺؼ�����������˲�����ע����������֪ʶ�����չ��˲���ע�������һ���������͡������������˺���Һ��Ȼ���ǵĿ���ԭ����:�ٳн���Һ���ձ����ɾ����㵹Һ��ʱҺ�������ֽ��Ե����ֽ�����Լ�����д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����⣬�˽�ע�⣺a����ƽ b������ c�����ţ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Ʒ�к�������NaCl��С��ͬѧȡ����Ʒ23gȫ���ܽ���150gˮ�У�����μ���160gϡ���ᣬ��Ӧ�в���������������������������ϵ��ͼ��ʾ�����㵱ǡ����ȫ��Ӧʱ��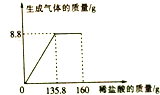
��1�������Ķ�����̼���������ˣ�
��2����Ʒ��̼���Ƶ�����Ϊ�ˣ�
��3����ʱ���õ�����Һ���Ȼ��Ƶ���������Ϊ���٣���д����Ҫ�ļ�����̣����������0.1% ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�غ���Ԫ�صı����������ڣ� ��
A.���ԭ��������ͬ
B.�˵������ͬ
C.Ԫ�ط��Ų�ͬ
D.�����������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������N2��CO2��CO��ɵĻ����������ͨ�������ʯ��ˮ�����ȵ�CuO������ÿ�η�Ӧ���ܰ���Ӧ��������ȫ���գ�����ų�������Ϊ�� ��
A.CO2
B.N2��CO
C.N2��CO2
D.CO2��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�ٶ���������õ�����ȵ���ߣ������㷺��ʹ�ã�ԭ��֮һ�������Ŀ���ʴ���ܺá����������õĿ���ʴ���ܵ�ԭ���� �� ��
A.���Ļ�ѧ���ʲ�����
B.����������һ�����ܵ�����������Ĥ
C.�������²���������Ӧ
D.�������ᡢ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д������ͭ��������ϡ�����������ܷ�����Ӧ�Ļ�ѧ����ʽ����ע����Ӧ���͡�
.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰʯ��ׯ�����ڽ��е������裬�㷺ʹ�ý������ϣ����в����ںϽ���ǣ� ��
A.�̸�
B.����
C.Ӳ��
D.�ϳɲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������;��Ҫ������������Щ��Ҫ�������ʣ�
��1�����ߣ���
��2������ɻ�����
��3�����ô��ߣ���
��4����װ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ɷ��У���������϶��һ�ѧ���ʱȽϻ��õ������ǣ� ��
A.����
B.����
C.������̼
D.ˮ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com