解:(1)煤燃烧时产生的二氧化硫是形成酸雨的主要气体之一,酸雨的pH值小于5.6;
空气中含有二氧化碳,易溶于水形成碳酸,所以雨水显酸性;
故答案为:SO
2;<;空气中含有二氧化碳,水中溶了二氧化碳;
(2)根据化学方程式的书写步骤:写配注等,焦炭在高温下与水蒸气反应,得到CO和H
2,反应方程式为:
C+H
2O

CO+H
2;故答案为:C+H
2O

CO+H
2 ;
(3)因为天然气的密度比空气小,所以警报器应该安置在高处;
天然气燃烧的化学方程式:CH
4+2O
2 
CO
2+2H
2O;
故答案为:甲; CH
4+2O
2
CO
2+2H
2O;
(4)①工业用烧碱吸收SO
2的化学方程式为:2NaOH+SO
2═Na
2SO
3+H
2O;
故答案为:2NaOH+SO
2═Na
2SO
3+H
2O;
②假设两种溶液的体积都为v mL
vmL10%的NaOH溶液中所含OH
-质量:(v mL×1.1g/cm
3×10%)×

×100%=0.04675v g
vmL10%的KOH溶液中所含OH
-质量:(v mL×1.1g/cm
3×10%)×
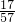
×100%=0.03282v g
0.0467v g>0.03282v g,所以,10%的NaOH溶液的碱性比10%的KOH溶液的碱性强;
故选A.
分析:(1)根据煤燃烧时产生的二氧化硫是形成酸雨的主要气体之一,酸雨的pH值小于5.6;进行解答;
正常雨水的PH约为5.6,显酸性,原因是空气中含有二氧化碳,水中溶了二氧化碳;
(2)根据化学方程式的书写步骤:写配注等,写出反应方程式;
(3)天然气的密度比空气小,报警器应该安置在高处;根据反应物和生成物及其质量守恒定律可以书写化学方程式;
(4)①根据化学方程式的书写步骤:写配注等,写出反应方程式;
②计算等体积的10%的NaOH溶液与10%的KOH溶液中OH
-数量,根据一定体积的溶液中OH
-数量越多溶液碱性越强,判断碱性的强弱关系.
点评:本题考查学生正确书写化学方程式及利用质量分数进行分析解题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力..


 CO+H2;故答案为:C+H2O
CO+H2;故答案为:C+H2O CO+H2 ;
CO+H2 ; CO2+2H2O;
CO2+2H2O; CO2+2H2O;
CO2+2H2O; ×100%=0.04675v g
×100%=0.04675v g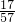 ×100%=0.03282v g
×100%=0.03282v g


 如何合理、高效、节约地使用煤、石油、天然气这三大化石燃料,加紧开发、研制其它清洁能源是全人类面临的共同课题,是发展低碳经济的当务之急.请按要求回答下列问题.
如何合理、高效、节约地使用煤、石油、天然气这三大化石燃料,加紧开发、研制其它清洁能源是全人类面临的共同课题,是发展低碳经济的当务之急.请按要求回答下列问题.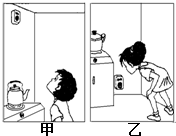 如何合理、高效、节约地使用煤、石油、天然气这三大当今世界最主要的化石燃料,加紧开发、研制其它清洁能源是全人类面临的共同课题,是发展低碳经济的当务之急.回答下列问题:
如何合理、高效、节约地使用煤、石油、天然气这三大当今世界最主要的化石燃料,加紧开发、研制其它清洁能源是全人类面临的共同课题,是发展低碳经济的当务之急.回答下列问题: