
我市庐江县小包庄去年发现一大型铁矿,主体为磁铁矿.冶炼磁铁矿的反应:4CO+Fe3O4 3Fe+4CO2.用100t含Fe3O480%的磁铁矿石,理论上冶炼含杂质4%的生铁多少?(答案保留一位小数)
3Fe+4CO2.用100t含Fe3O480%的磁铁矿石,理论上冶炼含杂质4%的生铁多少?(答案保留一位小数)
 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:计算题
某同学为了测定一瓶过氧化氢溶液中溶质的质量分数,取该溶液20g,加入二氧化锰0.5g,完全反应后,称得烧杯内剩余物质的总质量为19.7g.请回答下列问题:
(1)二氧化锰在反应中的作用是 。
(2)计算该过氧化氢溶液中溶质的质量分数。(请列式计算)
(3)现要配制100g溶质质量分数为3%的过氧化氢消毒液,需10%过氧化氢溶液的质量为 g。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
家里蒸馒头用的纯碱中常含有少量的氯化钠,某实验小组要测完该纯碱中碳酸钠的含量,现取该纯碱样品8g,加入一定质量的某稀盐酸中到不再产生气泡为止,得到2.2g气体,试计算并回答
(1)纯碱样品中碳酸钠的质量分数?
(2)反应后所得氯化钠溶液中溶质的质量?
(3)你能否算出反应后所得到溶液中溶质质量分数 ,你的理由是 .
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(本题包括1小题,共12分)
27.(11分)四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数,反应原理为:2 Na2S4 + O2 + 2H2O =" 8S↓+" 4 NaOH。
【实验资料】
①四硫化钠(Na2S4)的相对分子质量为 ,其中硫元素的质量分数为 (结果精确到0.1%)。
②四硫化钠受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢。
③NaOH溶液呈碱性,可吸收硫化氢、二氧化碳、二氧化硫等酸性气体
④硫代硫酸钠(Na2S2O3)可溶于水,常温下与NaOH溶液不反应。
【实验过程】
①取碳酸钠、 硫粉混合后置于试管中,加热(如图1所示,夹持装置已略去),制得Na2S4,反应为4Na2CO3 + 12S + X  2 Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。
2 Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为 ,蘸有浓NaOH 溶液的棉花的作用是 。 
②冷却后,取下棉花,放置一段时间,再向该试管中加入10ml水,迅速塞紧橡胶塞,充分振荡,测量液面至橡胶塞下沿的距离,记录数据h1(如图2所示)
③将该试管插入水中(如图3所求),取下橡胶塞,观察到
,塞紧橡胶塞。将试管取出,倒过来,测量液面至橡胶塞下沿的距离,记录数据h2,理论上h1:h2=
④按照①~③再重复实验2次.3次实验数据如下表所示。
| | 第1次 | 第2次 | 第3次 |
| h1/cm | 11.2 | 11.4 | 11.6 |
| h2/cm | 8.9 | 9.1 | 9.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:
①称取25.0g石灰石样品,平均分成两份,并分别加工成块状和粉末状;
②将两份样品分别投入两个锥形瓶中,各加入足量的相同溶质质量分数的稀盐酸(样品所含杂质不溶于水也不与酸反应),测得生成二氧化碳的质量与反应时间的关系如图所示。请回答: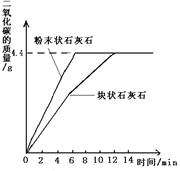
(1)由图中曲线分析得出,影响该化学反应速率的因素是: ;请另外举出—个生活或生产中控制化学反应速率的实例: 。
(2)每份样品充分反应后.生成二氧化碳的质量为 .
(3)若每份样品中加入l00.0g稀盐酸,恰好完全反应,求反应后所得溶液中溶质的质量分数。(要求写出计算过程.不考虑水、氯化氢的逸出.结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某炼铁厂用含杂质20%的赤铁矿为主要原料来炼铁,若该炼铁厂每天炼得含杂质4%的生铁100t,则每天至少需该赤铁矿多少吨?(计算结果保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
在一烧杯中盛有24.3g Na2SO4和NaCl组成的固体混合物,加入100g水使Na2SO4和NaCl全部溶解。向其中逐渐滴加溶质质分数为20%的氯化钡溶液,生成沉淀的总质量与所滴入氯化钡溶液的质量关系曲线如图所示。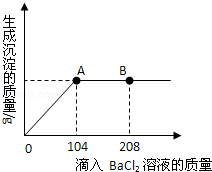
(1)请分析当BaCl2溶液滴加到B点时,溶液中的溶质是 。
(2)请计算当滴加BaCl2溶液至图中A点时,所得溶液的溶质质量分数(计算结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
现有一定质量含有少量泥沙等不溶性杂质和少量Na2SO4,MgCl2,CaCl2等可溶性杂质的粗盐样品,某实验小组利用化学实验室常用仪器对粗盐样品进行提纯,提纯步骤如下: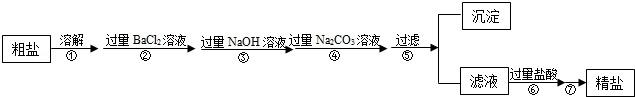
请根据提纯步骤回答下列问题.
(1)步骤⑦的操作名称为 .
(2)请写出实验步骤②中所涉及的化学方程式 .
(3)步骤⑥中加入过量盐酸的目的是 .
(4)步骤②和步骤④ (填“可以”或“不可以”)颠倒,理由是 .
(5)检验步骤④中Na2CO3溶液已过量的方法是 .
(6)加碘食盐相关信息如图所示.
食盐中的碘酸钾(KIO3)在酸性条件下,可以将碘化钾(KI)变成碘(I2),化学方程式如下:
KIO3+5KI+6HCl=6KCI+3I2+3H2O
①向装有碘化钾和淀粉混合液的试管中,滴入稀盐酸将溶液酸化,再加入食盐,若食盐中有碘化钾,则加入食盐后的实验现象 .
②小强同学欲测定加碘盐中碘元素的质量分数,实验步骤如下:取10g食盐样品于试管中加水溶解,加入过量KI的和淀粉混合溶液,再滴入稀盐酸将溶液酸化使其充分反应后,调节溶液呈中性,再向试管中滴加硫代硫酸钠溶液(Na2S2O3),发生化学反应方程式为:2Na2S2O3+I2═Na2S4O6+2NaI
当加入质量分数为0.237%Na2S2O3溶液2g时,I2恰好反应完全,通过计算判断该食盐样品是否合格(已知Na2S2O3的相对分子质量为158.请写出计算过程).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com