
��7�֣�Ϊ�ۺ��������������еĸ���ƷCaSO4��ij����������������Ʊ�(NH4)2SO4�Ĺ������̣�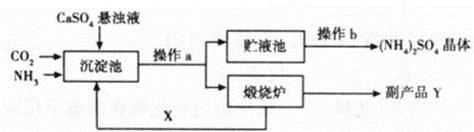
��1���������У��ڳ����ط����Ļ�ѧ��ӦΪCO2+2NH3+CaSO4+H2O==CaCO3��+ (NH4)2SO4
������¯�з����Ļ�ѧ��Ӧ����ʽΪ ���ù����п�ѭ��ʹ�õ�XΪ (�ѧʽ)������ƷY�к���; (��һ�ּ���)��
��2������Һ���л��(NH4)2SO4����Ҫ���в���b������b�� ��������һ�����������Һ���У��γ�30��ʱ(NH4)2SO4�ı�����Һ�����ʱ������������Ϊ ����֪30��ʱ����淋��ܽ��Ϊ78g����
��3�����Ʊ�6.6t (NH4)2SO4���壬��������ҪCaSO4���ٶ֣�
��1��CaCO3 CaO+CO2�� CO2 ʳƷ�������
CaO+CO2�� CO2 ʳƷ�������
��2������ 43.8%
��3��6.8��
���������������1������¯�е�������̼��ƣ���ѧ��Ӧ����ʽΪ��CaCO3 CaO+CO2�����ù����п�ѭ��ʹ�õ�XΪCO2�����и���ƷY�������ƣ���;�ǣ�ʳƷ�������
CaO+CO2�����ù����п�ѭ��ʹ�õ�XΪCO2�����и���ƷY�������ƣ���;�ǣ�ʳƷ�������
��2������Һ���л��(NH4)2SO4����Ҫ���в���b������b�ǣ�������������һ�����������Һ���У��γ�30��ʱ(NH4)2SO4�ı�����Һ����֪30��ʱ����淋��ܽ��Ϊ78g�����Դ�ʱ������������Ϊ=78g/178g��100%=43.8%
��3�����ݻ�ѧ����ʽ��CO2+2NH3+CaSO4+H2O==CaCO3��+ (NH4)2SO4��(NH4)2SO4��CaSO4��������ϵ���������CaSO4������
�⣺��CaSO4������Ϊx
CO2+2NH3+CaSO4+H2O==CaCO3��+ (NH4)2SO4
136 132
x 6.6t
136��132=x��6.6t
x=6.8t
���㣺��ѧ����ʽ����д���������������ļ��㣬���ݻ�ѧ����ʽ���㣬����ʵ�����


 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
ij������Ʒ�л����������Ȼ��ƣ�Ϊ�˲ⶨ��Ʒ�Ĵ��ȣ�С����������ʵ�飺ȷ��ȡ��Ʒ12.0g�������м���57.9gϡ���ᣬǡ����ȫ��Ӧ������������4.4g����ش��������⣺
��1��С��Ҫ�ӷ�Ӧ�����Һ����ȡNaClӦ���õķ����� ��
��2��������Ʒ�е�Na2CO3�����������Ƕ��٣����������һλС����Ҫ��д��������̣�
��3����Ӧ��������Һ��NaCl�����������Ƕ��٣���Ҫ��д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��12�֣�ij���������к���̼������ʣ���ȡ��ϸ�ĸ���Ʒ12.4g������ƿ�У�����32.6gˮ��������γ�����Һ��������ƿ����εμ�����ʹ���ַ�Ӧ�������ݲ�������ü����������������ƿ�����ʵ�������ϵ���±���ʾ��
| �������������/g | 0 | 25 | 37.5 |
| ��ƿ�����ʵ�����/g | 45 | 70 | 80.3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
Ϊ�Ӷ����Ƕ���ʶ�кͷ�Ӧ��С��ͬѧ������Ʋ�����������ʵ�飺
����С�ձ��е���8��������������Һl0g������2�η�̪�Լ�����Һ�ʺ�ɫ��
����ȡ10����ϡ������εμӵ�����������Һ�У��ߵα�����������룬��Һ��ɫ��dz��
������Һ��ɫ��ʧ˲�䣬ֹͣʵ�顣
��ֹͣʵ��ʱ������Һǡ�÷�Ӧ�������С��ʵ���ش�
��1��ʵ���з�̪�Լ���������_________________________��
��2���������ʱ����ȥϡ����������Ƕ���?(��ȷ��0��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��7�֣���һ�ձ���ʢ��60.2gBaCO3��BaCl2�ķ�ĩ״���������м���188.8gˮʹ������п�������ȫ�ܽ⣬Ȼ����������μ���������������Ϊ10%��ϡ������146gʱǡ�÷�Ӧ��ȫ�����������ش����⣺
��1���ڵμ���������й۲쵽������ʵ�������� ��
��2��������μ���140gʱ���ձ�����Һ�ﺬ�����ʵ��� ����д��ѧʽ��
��3������ǡ�÷�Ӧ��ȫʱ�ձ������ò�������Һ���������������ȷ��0.1g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��18�֣���������茶�������ΪĦ���Σ���ѧʽΪxFeSO4��y(NH4)2SO4��zH2O������ҩ����Ʒ����й㷺��Ӧ�á�
���ϣ� ����������茶���������ˮ���������Ҵ���
��������ʵ��ܽ�ȣ���λ��g�����±���
| �¶�/�� | FeSO4 | (NH4) 2SO4 | xFeSO4��y(NH4)2SO4��zH2O |
| 10 | 20.0 | 73 | 17.2 |
| 20 | 26.5 | 75.4 | 21. 6 |
| 30 | 32.9 | 78 | 28.1 |



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��7 �֣���ˮѡ�����ҹ��Ŵ��Ͷ���������һ���������ѡ���ӵķ�����ũҵ�����ϳ����������� 15%��20%���Ȼ�����Һ��ѡ�֡�Ϊ�˲ⶨij�Ȼ�����Һ�Ƿ����Ҫ��ȡ����Һ70g������һ���������������� AgNO3��Һ 100g��ǡ����ȫ��Ӧ�����˷��������������Ϊ28��7g��
��1���������Ȼ�����Һ�IJ��������У��ܽ�ʱ��Ҫ�õ����������������� ��
��2����Ӧ��������Һ������Ϊ g��
��3��ͨ������ȷ�����Ȼ�����Һ�Ƿ����ѡ��Ҫ����������ȷ��0��1%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�������ͼ��ʾ��ʵ����̺��ṩ�����ݣ�����ڲ���������ȫ���ݳ������ش��������⣺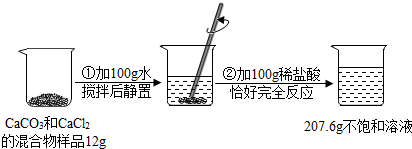
��1��ʵ������ϡ��������ʵ���������Ϊ 7.3%��
��2������ԭ�������Ʒ��CaCl2��������д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
ʹ����ͭ�Ļ���� 20 g��������ϡ���ᷴӦ�����Ƶ�����0.4 g����ԭ�����������ͭ��Ϊ���ٿˣ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com