
 人类的生活和生产都离不开金属材料.
人类的生活和生产都离不开金属材料.分析 (1)铁在空气中锈蚀,实际上是铁跟空气中的氧气和水共同作用的结果.
根据灭火原理:①清除或隔离可燃物,②隔绝氧气或空气,③使温度降到可燃物的着火点以下,据此结合灭火方法进行分析解答.
根据铝的密度、铝易与氧气反应生成致密的氧化铝薄膜,进行分析解答.
(2)验证三种金属活动性强弱时,通常采取“三取中”的方法,即取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应.
解答 解:(1)铁在空气中锈蚀,实际上是铁跟空气中的氧气和水共同作用的结果,故铁锅生锈的条件是:铁与空气和水直接接触.
炒菜时铁锅中的油着火可用锅盖盖灭,其原理是隔绝氧气;
铝的密度小,故铝锅轻便;常温下,铝能与氧气反应表面生成致密的氧化铝薄膜,阻止铝的进一步氧化,因此铝锅比较耐用.
(2)在验证三种金属活动性强弱时,通常采取“三取中”的方法,即取中间金属单质与两端的金属的盐溶液反应或取中间金属的盐溶液与两端金属的单质反应,验证镁、铁、铜的活动性顺序,他选择了打磨过的铁丝,他还需要的另外两种溶液是硫酸镁溶液、硫酸铜溶液(合理即可).
故答案为:(1)水;隔绝氧气;密度小,常温下易与氧气反应表面生成致密的氧化铝薄膜,阻止铝的进一步氧化;
(2)硫酸镁溶液、硫酸铜溶液(合理即可).
点评 本题难度不大,掌握金属的化学性质与物理性质、铁锈蚀的条件、灭火的原理等是正确解答本题的关键.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:初中化学 来源: 题型:实验探究题
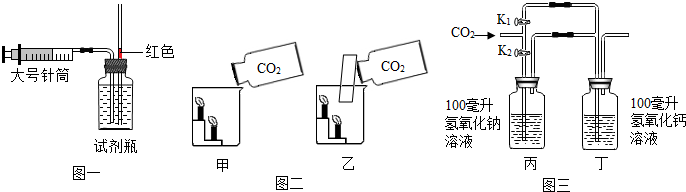
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只有二氧化锰能做催化剂 | |
| B. | 催化剂加快反应速率 | |
| C. | 催化剂不能减缓反应速率 | |
| D. | 反应前后催化剂的化学性质不会改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
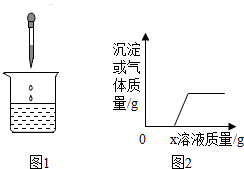 向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )
向烧杯中逐滴加入x溶液至过量(图1),生成沉淀或气体的质量与加入溶液的质量关系符合图2的是( )| 烧杯中的物质 | x溶液 | |
| A | 氯化钠和碳酸氢钠溶液 | 稀盐酸 |
| B | 需硫酸和稀盐酸 | 氯化钡溶液 |
| C | 黄铜粉末 | 稀盐酸 |
| D | 稀盐酸和硫酸镁溶液 | 烧碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 测定结果 | 白色固体成分 |
| 用pH试纸测定反应后溶液的酸碱度,操作方法是 | pH>7 | |
| CaCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com