
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解
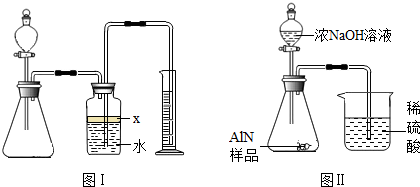
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
(2004?杭州)20℃时,物质的溶解度在0.1克~1克范围内为微溶.已知CaS04的溶解度如下表所示
|
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
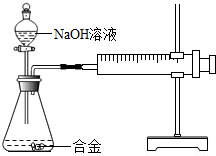 (2013?徐州)合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.
(2013?徐州)合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动.| 实验步骤 | 实验现象 | 结论 |
| ①取一定量的合金粉末,加过量的 30%的NaOH溶液 30%的NaOH溶液 ,充分反应后过滤,滤渣备用 |
粉末部分溶解,并有无色气体放出 | 合金中一定含有 铝 铝 |
| ②取步骤①所得滤渣,加过量 20%的硫酸溶液 20%的硫酸溶液 ,充分反应 |
滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 | 合金中一定含有 铁、铜 铁、铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 氢氧化钠溶液 | 氯化钠溶液 | 碳酸钾溶液 | 硝酸银溶液 | |
| 稀盐酸 | 示例:① 能 能 反应 |
② 不能 不能 反应 |
③ 能 能 反应 |
④ 能 能 反应 |
| 判断依据 | 示例: 有水生成 有水生成 |
无沉淀或无水或气体生成 无沉淀或无水或气体生成 |
有气体和水生成 有气体和水生成 |
有沉淀生成 有沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com