
【题目】利用能源、节约能源、保护环境是我们大家共同关注的问题。

(1)充分燃烧1000 g天然气和煤所产生的CO2和SO2气体的质量如图所示,则_______燃烧对环境影响较小,1000 g煤中硫元素的质量为_______(假设硫元素完全转化为SO2)。
(2)SO2的大量排放能形成酸雨,pH_______(填“<”“>”或“=”)5.6的降雨称为酸雨。在煤燃烧后将烟气通入吸收塔并“喷淋”石灰水进行“脱硫”可减少SO2的排放,石灰水需要“喷淋”的目的是__________。工业上常用熟石灰处理含有硫酸的废水,反应的化学方程式为________________。
(3)目前,在汽车尾气系统中安装催化转化器可将污染物CO、NO转化为无毒的CO2和N2,化学方程式为:_______________。请根据“在化学反应过程中有元素化合价变化的化学变化,叫做氧化还原反应”判断,该反应_______(填“是”或“不是”)氧化还原反应。
【答案】天然气 5g < 使SO2被充分吸收 H2SO4+Ca(OH)2=CaSO4+2H2O 2CO+2NO 2CO2+N2 是
2CO2+N2 是
【解析】
解:(1)两种燃料燃烧对环境影响较小的是天然气;由图可知1000g煤产生10g二氧化硫,其中硫元素的质量为10g×![]() ×100%=5g;
×100%=5g;
(2)SO2的大量排放能形成酸雨,其pH<5.6;根据题意,H2SO4和石灰水反应生成硫酸钙和水,反应的化学方程式为H2SO4 +Ca(OH)2 ═CaSO4+2H2O;
(3)一氧化碳与一氧化氮在催化剂的作用下反应生成二氧化碳与氮气,凡有元素化合价变化的化学反应就叫做氧化还原反应,反应前后,氮元素的化合价发生了改变,则该反应属于氧化还原反应。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:初中化学 来源: 题型:
【题目】课本“分解过氧化氢制氧气的反应中二氧化锰的催化作用”以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 | |
Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 |
(实验结论)
(1)A中产生的气体是_____________。
(2)实验Ⅱ、Ⅲ证明:氧化铁的___________和____________在反应前后均没有发生变化,可以作过氧化氢溶液分解的催化剂。
(3)写出氧化铁催化过氧化氢溶液分解的化学方程式 ____________。
(实验评价)
(1)实验设计Ⅳ的目的是比较__________________。
(实验拓展)
(1)查阅资料得知:CuO、CuSO4、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是______________(填序号)。
A MnO2只能作过氧化氢溶液分解的催化剂
B 同一个化学反应可以有多种催化剂
C 催化剂只能加快化学反应的速率
D 用作催化剂的物质不可能是其他反应的反应物或生成物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请阅读以下摘自今年的《苏州日报》,与化学关系密切的信息,并填空.
[资讯1]据市环境监测站专家5月4日至7日,由于阳光灿烂,臭氧( O3)也出来“作怪”,连续四天的日平均浓度也均超标.臭氧在常温常压下是淡蓝色气体,稳定性极差,可自行分解为氧气.臭氧在空气中达到一定浓度可刺激呼吸道.大气中臭氧浓度超标的原因是:在静风条件下强烈的阳光就成为氮氧化物的催化剂,从而推高了臭氧浓度,形成污染.
(1)臭氧“自行分解”的化学方程式为 ;若氮氧化物假定为二氧化氮,强光条件下促使其分解产生了O3和N2.则该反应的化学方程式为 .
[资讯2]吴江某公司研发的一层看似普通的白色薄膜,却有超高防水透气、阻燃、抗菌和耐腐蚀的神奇功能…这种膜的专业术语叫聚四氟乙烯纳米微孔薄膜,由聚四氟乙烯树脂经特殊设备和工艺制作而成,该树脂是一种超高分子量材料.
(2)制作这种薄膜的聚四氟乙烯树脂[(CF2CF2)n]的相对分子质量为1×108,其n值等于 .碳元素的质量分数为 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】按如表提供的信息,完成下列填空:

(1)H+核外电子数为_________;
(2)写出一条第三周期元素原子的核外电子排布规律_________;
(3)第7号元素与第12号元素的原子形成化合物的化学式为_________;
(4)X、Y、Z、W元素表示4种物质,它们的微观示意图如图:

物质X和Y在高温和催化剂条件下反应生成Z和W两种物质,反应的化学方程式为_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法正确的是( )
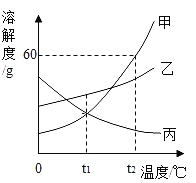
A.t1℃时,三种固体物质的溶解度关系为乙>甲>丙
B.t2℃100 g甲物质饱和溶液中含有60 g甲
C.将丙物质饱和溶液变为不饱和溶液,可采用升温的方法
D.t2℃时分别用100 g水配制甲、乙的饱和溶液,降温到t1℃,析出固体的质量甲>乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室用含杂质的锌与稀硫酸反应制取氢气,取8g含杂质的锌粒于烧杯中(所含杂质不溶于水,也不与酸反应),向其中加入74.2g稀硫酸,恰好完全反应后烧杯内剩余物质的质量为82g.计算:
(1)生成氢气的质量______g.
(2)反应后所得溶液的溶质质量分数(请写出计算过程)__________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】写出下列化学用语
(1)2 个硫原子________;
(2)氦气________;
(3)硫酸铁________;
(4)3 个铵根离子________;
(5)H2O中2的意义________;
(6)氧化钙中钙元素显+2 价________;
(7)地壳中含量最高的金属元素是________,它对应的氧化物的化学式为________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钙是人体必需的元素,如图是市售某补钙药品的部分说明书。请回答:

①CaCO3中Ca,C,O三种元素质量比为_____。
②CaCO3中钙元素的质量分数为_____。
③如果按用量服用,则每天摄入钙元素的质量为_____g。
④若服用含10gCaCO3的药物,与_____g葡萄糖酸钙[化学式Ca(C6H11O7)2,相对分子质量430]中钙元素的质量相等。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学利用下列装置制取氧气并验证氧气的性质.
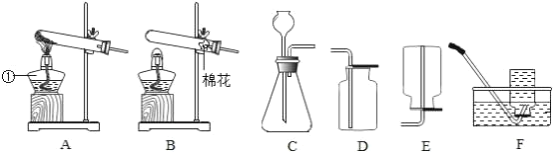
(1)请写出编号为①的仪器名称_____.
(2)用装置D收集氧气的依据是_____,用这种方法收集氧气,验满的方法是_____.
(3)在实验室用B、F装置制取氧气,选用的试剂是_____,发生反应的文字表达式为_____试管口放棉花的作用为_____实验前必须进行的操作是_____,收集完毕时的操作是_____.
(4)实验室常用锌粒和稀硫酸反应制取氢气,氢气是一种易燃,密度比空气小的气体,难溶于水。用上述装置制取氢气,你选择的发生装置是_____收集装置是_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com