
【题目】(1)用化学用语填空:
① 氖气____________________;
② 氧化铜中铜元素的化合价为 + 2 价___________________;
③ 保持水的化学性质的最小微粒_________________;
④ 硫酸铁__________________。
(2)世界长寿乡—蕉岭,是一个美丽宜居的好地方。蕉岭长寿的关键因子是水土富硒,硒元素具有抗衰老、抑制癌细胞生长的功能,其元素符号为Se。
①硒原子的结构示意图为![]() n 的值为___________;
n 的值为___________;
②硒原子在化学反应中得到电子形成离子,其离子符号是_____________。
【答案】 Ne ![]() H2O Fe(2 SO4)3 18 Se2 -
H2O Fe(2 SO4)3 18 Se2 -
【解析】(1)①氖气是由原子构成的物质,化学式直接用元素符号表示,氖气表示为:Ne;②元素的化合价直接在该元素正上方标出相应的化合价,故氧化铜中铜元素的化合价为 + 2 价表示为:![]() ;③ 保持物质化学性质的微粒是分子,故保持水的化学性质的最小微粒是:H2O;④ 硫酸铁中铁显正三+3价,硫酸根显-2价,根据化学式的表示方法,硫酸铁表示为:Fe2(SO4)3;(2)①由硒原子的结构示意图为
;③ 保持物质化学性质的微粒是分子,故保持水的化学性质的最小微粒是:H2O;④ 硫酸铁中铁显正三+3价,硫酸根显-2价,根据化学式的表示方法,硫酸铁表示为:Fe2(SO4)3;(2)①由硒原子的结构示意图为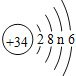 可知,硒原子的核外有4个电子层;根据质子数等于核外电子数,n的值=34-2-8-6=18;② 最外层电子数6,所以容易得到2个电子形成阴离子,所以其离子符号是Se2-。
可知,硒原子的核外有4个电子层;根据质子数等于核外电子数,n的值=34-2-8-6=18;② 最外层电子数6,所以容易得到2个电子形成阴离子,所以其离子符号是Se2-。


科目:初中化学 来源: 题型:
【题目】某化学兴趣活动小组的同学学习“灭火器原理”后,设计了如图所示实验,并对反应后锥形瓶中残留废液进行探究。
(提出问题)废液中所含溶质是什么物质?
(猜想与假设)
猜想1:废液中的溶质可能是NaCl、Na2CO3和HCl。 猜想2:废液中的溶质只有NaCl。
猜想3:废液中的溶质是NaCl和HCl。 猜想4:废液中的溶质是______。
(讨论与交流)
小明认为猜想1无需验证就知道是错误的。他的理由是______。
(实验与结论)
(1)为验证猜想2,小强同学取少量废液装入试管中,然后滴入AgNO3溶液,产生白色沉淀,滴加稀硝酸沉淀不溶解。于是小强认为猜想2正确。小强的实验______(填“能”或“不能”)验证猜想2的正确性,原因是______。
(2)小丽为验证猜想3,选锌粒做试剂。若猜想3是正确的,验证时反应的化学方程式为______。
(3)若验证猜想4是否正确,下列试剂中可选用的有______(填序号)。
①氢氧化钠溶液 ②氯化钙溶液 ③稀盐酸 ④氯化钾溶液
(拓展与应用)
(4)若废液中的溶质是NaCl和HCl,根据HCl的性质,无需另加试剂,只要对废液进行______操作即可从废液中得到NaCl固体。此方法的缺点是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】臭氧(O3)是地球大气中一种微量气体,主要分布在10~50km高度的平流层大气中。它吸收对人体有害的短波紫外线,防止其到达地球,保护地球表面生物不受紫外线侵害。生活中,臭氧食具消毒柜是通过臭氧进行食具消毒。臭氧支持燃烧,可燃物在臭氧中燃烧较氧气中更加剧烈。某兴趣小组对臭氧进行如下探究。
资料:①臭氧可由氧气通过高压电击转变而得;②臭氧微溶于水,能使红色品红溶液变为无色;③臭氧用作气体消毒剂,但浓度超标时对人体有毒副作用。
(探究一) 臭氧气体的制备

(1)利用图中A装置可制得氧气的化学方程式是_________________________;A装置还可用于实验室制取_______,可用__________________反应来制取。
(2)将A中制得的氧气依次通过B和C装置,开启C中高压电开关,在C装置导管末端接上集气装置,就可收集到臭氧。B装置的作用是___________________。将带火星的木条伸入集满臭氧的集气瓶中,可观察到的现象是___________________。
(3)图中C装置中产生臭氧的化学反应方程式是___________________________。除电击法制取臭氧外,用过氧化钡(BaO2)固体与浓硫酸反应也可制臭氧,同时生成硫酸钡和水。反应的化学方程式为____________________。
(4)将A中制得的氧气依次通过B和C、D装置,开启C中高压电开关,根据______现象说明氧气转变成臭氧。
(5)从安全、环保角度看,上述装置不足之处是___________________。
(探究二) 影响臭氧分解速率的因素
O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。

(6)从表中数据进行分析,臭氧的分解速率与_________、__________有关。据表推测臭氧的分解速率受温度影响情况是_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,请根据溶解度曲线回答下列问题:

(1)t 3 ℃ 时,将 30g 甲物质加入到 50g 水中,充分溶解后所得溶液的质量为______g。
(2)当甲中含有少量乙时,提纯甲的方法是_________。
(3) t 3 ℃ 时等质量的甲、乙、丙三种物质的饱和溶液降温至 t 1 ℃,所得溶液中溶质的质量分数由大到小的顺序为__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为A、B、C三种固体物质(不含结晶水)的溶解度曲线。下列有关说法错误的是

A. t1℃C三种物质中B物质的溶解度最大
B. t2℃三种物质的饱和溶液中,溶质的质量分数最大的是A
C. 可用降低温度的方法使t2℃时C的饱和溶液变为不饱和溶液
D. 将t2℃A、B、C三种物质的饱和溶液降温到t1℃,溶质的质量分数的大小关系是B>A=C
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
(提出问题)白色固体是什么物质?
(做出猜想)小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二:__________________;猜想三:Ca(OH)2。
他的依据是____________________。
(交流反思)经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是:_______________。
(进行实验)
(1)取少量白色固体放入试管中,滴加稀盐酸,没有观察到____________,证明猜想二不成立。
(2)取少量白色固体加入到水中,静置后取上层清液,___________,有白色沉淀出现,证明猜想三成立。该反应的化学方程式为:_____________。
结论:白色固体是Ca(OH)2。由碳化钙与水反应制取乙炔的化学方程式为___________
(拓展应用)已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小。实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的发生装置是_____,收集装置是_________(选填图中装置序号)。
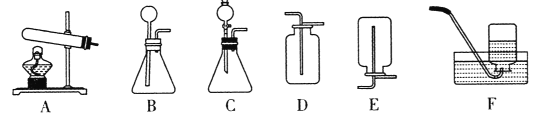
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:
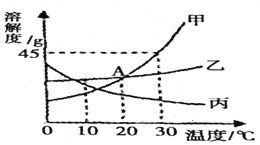
(1)A点的含义是______。
(2)在30℃时,向30克甲物质中加人50克水.充分溶解后所得溶液是______溶液 (填" 饱 和”或“不饱 和” )。
(3)若乙中混有少量甲,最好采用______的方法提纯乙(填“降温 结晶”或“蒸 发 结 晶” )。
(4)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究性学习小组对中和反应进行探究,请你参与实验
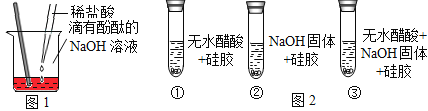
(探究活动1)证明酸和碱发生了反应小丽同学按图1进行实验,证明了盐酸和NaOH溶液能发生化学反应,他依据的实验现象是_______;反应的化学方程式________;玻璃棒的作用是_____。
(探究活动2)能否通过证明有水生成来证明其反应的发生?
(设计实验)小明同学取变色硅胶、无水醋酸和氢氧化钠固体进行如图2所示的三个实验。
(小资料)a.变色硅胶吸水后由蓝色变为红色;
b.无水醋酸是一种酸,常温下为无色液体;
(1)实验①、②的目的是____________________;
(2)加入试剂后,要迅速塞紧橡胶塞的原因是____________________;
(3)上述三支试管中能证明酸和碱反应有水生成的现象是_______________;
(4)除了上述方法之外,还可以按照下表实验方法证明稀盐酸与氢氧化钠发生了反应,说出对应的实验现象和实验结论:
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量稀盐酸,再加入少量氧化铜 | _______ | 氢氧化钠和盐酸发生了反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室常用的实验仪器与装置,根据所学知识回答下列问题:

(1)写出图中编号仪器名称:① 。
(2)用高锰酸钾制取氧气时,所选用的发生装置是 (填装置序号),该装置还需添加的实验用品为 ,反应的化学方程式为 。
若用D装置对氧气进行干燥,可将其中的水换成 。
(3)为了粗略测定加热一定质量的高锰酸钾所收集到氧气的体积,整套实验装置导管接口的正确连接顺序是 (依次填导管接口,用a、b、c……表示);
(4)实验室若用装置B制取二氧化碳,多孔隔板上常放置的药品应为 (填名称),其反应的化学方程式为 。若用过氧化氢溶液和二氧化锰粉末制取氧气, (填“能”或“不能”)用B装置控制反应的发生与停止。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com