
【题目】(12分)以下是甲、乙两同学对有关镁与盐酸反应的系列研究。
研究一:镁与盐酸反应过程中的能量变化以及反应速率的变化:
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是 反应(填
“吸热”或“放热”)。
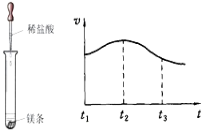
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,
则t1~t2时间内反应速率逐渐加快的主要原因是 。
研究二:反应后所得溶液的酸碱性探究:
(3)甲同学反应后用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶
液呈 性(选填“酸”“碱”或“中”)。
甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7。为
验证猜想,甲同学需测定 溶液的酸碱性,实验表明该溶液显弱酸性。
(4)乙同学重复甲同学实验时,发现反应后所得试管中溶液pH大于7。发现实验与甲同学实
验不同的是,反应后的试管中镁条有剩余。乙同学猜想可能是镁与热水反应生成了碱性
物质。乙同学为验证猜想,在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶
液很快变为红色,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,
请根据实验现象写出镁与水反应的化学反应方程式 。
(5)金属氯化物溶液pH值大小与金属的活动性有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,则氯化钾溶液显 性。
(6)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。由
此可见金属与水反应与金属的活动性顺序 (填“有关”或“无关”)。
研究三:金属活动性强弱与原子结构的关系:
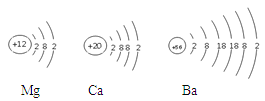
下图为镁原子、钙原子和钡原子结构示意图。已知其中Ba的活动性最强,据此推测,金属的活动性除与原子的最外层电子数有关,还与 有关。
研究四:确定镁条的成分:
称取3.2g表面被氧化的镁条, 放入100g稀盐酸中恰好完全反应,生成气体0.2g。求:
(7)此镁条中金属镁的质量。(写出计算过程,共3分)
(8)反应后所得溶液中溶质的质量分数 。(计算结果保留一位小数)
【答案】研究一:(1) 放热 (2) 镁与稀盐酸反应放热,加快反应速率
研究二:(3) 酸性 氯化镁 (4) Mg +2H2O === Mg(OH) 2↓+H2 ↑
(5)中性 (6)有关
研究三:电子层数
研究四: (7)m(Mg)=2.4g (8) 11.1%
【解析】
试题分析:研究一:(1) 反应中试管外壁发烫,说明镁与稀盐酸反应是放热反应
(2) 实验测得镁片产生气体的速率(v)与时间(t)的关系如右图所示,则t1~t2时间内反应速率逐渐加快的主要原因是:镁与稀盐酸反应放热,加快反应速率
研究二:(3)用pH试纸测定试管中溶液的酸碱性,发现pH小于7,说明甲同学所得溶液呈酸性;甲同学:猜想Ⅰ:稀盐酸过量,使溶液pH小于7;猜想Ⅱ:氯化镁溶液pH小于7,因为主要是因为溶液显酸性,所以只要测定氯化镁溶液的酸碱性,实验表明该溶液显弱酸性
(4)在滴有两滴酚酞的热水中放入一段打磨过的镁条,观察到溶液很快变为红色,,说明反应形成了一种碱,同时还观察到镁条表面有气体生成,收集并点燃该气体,发现能燃烧,可以判断是氢气,所以镁与水反应的化学反应方程式:Mg +2H2O === Mg(OH) 2↓+H2 ↑
(5)金属氯化物溶液pH值大小与金属的活动性有关,如氯化钠溶液显中性,氯化镁溶液显弱酸性,从中可以得出结论:金属的活动性越强,形成的金属氯化物溶液显中性,而钾的活动性比钠强,故氯化钾溶液显中性
(6)活泼金属能与水在一定条件下反应。实验发现钠与冷水剧烈反应,产生大量的气体。而金属镁要与热水反应,说明金属与水反应与金属的活动性顺序有关
研究三:金属镁的原子核外有3个电子层,金属钙的原子核外有4个电子层,金属钡的原子核外有6个电子层,而Ba的活动性最强,据此推测,金属的活动性除与原子的最外层电子数有关,还与电子层数有关
研究四:根据反应:Mg+ 2HCl === MgCl2 + H2↑中氢气与Mg的质量关系,即可求出镁的质量,还发生了一个反应:MgO+2HCl==MgCl2+H2O, 反应后所得溶液中溶质是MgCl2,先根据方程式,算出MgCl2的质量,再计算溶质的质量分数
解:设金属镁的质量为x,生成MgCl2的质量为y
Mg+ 2HCl === MgCl2 + H2↑
24 95 2
X y 0.2g
(7) 24:2=x:0.2g x=2.4g
95:2=y:0.2g y=9.5g
(8)由于MgO的质量=3.2g-2.4g=0.8g,设生成的MgCl2的质量为z
MgO+2HCl==MgCl2+H2O
95
0.8g z
40:95=0.8g:z z=1.9g
故MgCl2的质量的总质量=9.5g+1.9g=11.4g
而溶液的总质量=3.2g+100g-0.2g=103g
溶质的质量分数=11.4g/103g×100%=11.1%


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】元素及其化合物知识是化学研究和学习的重要内容。
(1)氯化钠、氯化钙和氯化镁中都含有氯元素,下图是氯在元素周期表中的相关信息,下列说法不正确的是 (填标号)。
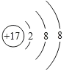

A.该元素属于非金属元素
B.该原子核内质子数为17
C.该元素的原子形成阴离子后,离子结构示意图为
D.该元素的相对原子质量为35.45g
根据生活经验,汗水含有的某物质有咸味,构成该物质的微粒是 (填粒子符号)。
碳酸氢钠在焙制糕点和炸油条时常用作发泡剂,用化学方程式解释其原理
(4)现有一包白色粉末,其中含有CuSO4、BaCl2、NaOH、Na2CO3中的一种或几种。某化学小组为确定白色粉末的成分,进行了如下实验:(I)取一定量白色粉末,加入足量水,振荡,得到无色透明溶液;(Ⅱ)取少量(I)的溶液,加入足量盐酸,有气泡产生。(提示:BaCO3难溶于水;Na2CO3的水溶液呈碱性)
①该白色粉末中肯定含有什么物质?可能含有什么物质?
②为确定可能含有的物质是否存在,还需要作进一步的实验验证,请写出简要的实验步骤。
食用纯碱中常含有少量的氯化钠。现取某食用纯碱样品20g,加入一定量稀盐酸恰好完全反应,同时产生了6.6g气体。试计算该食用纯碱中碳酸钠的质量分数。(写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分类是学习化学的方法之一。下列物质按单质、盐、混合物的顺序排列的是
A.氧气、碳酸钙、空气 B.氢气、硫酸钠、水
C.甲烷、食盐、冰水 D.金刚石、熟石灰、石油
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)(1)下图是甲、乙两种物质的溶解度曲线。
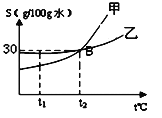
①t2℃时,溶解15g甲物质,至少需要 g水。
②t2℃时,在烧杯中分别盛有等质量的甲、乙两种溶质的
饱和溶液,从t2℃降温到t1℃时,对烧杯中剩余溶液描述
正确的是 。(填字母)
a.溶质的质量分数:甲>乙 b.析出固体的质量:甲>乙
c.甲是饱和溶液,乙是不饱和溶液 d.溶剂的质量:甲﹤乙
(2)X、Y、Z三种物质有如图所示的转化关系。
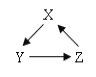
①若X为金属单质,Z为含X元素的可溶性盐。写出Y→Z且能体现酸的性质的反应方程式一个: 。
②若X为Ca(OH)2,则Y是 ,Z是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(9分)氯化钡是一种可溶性重金属盐,广泛应用于化工领域,用毒重石(主要成分为BaCO3)制备氯化钡晶体工艺流程如下:

(1)毒重石要进行粉碎的目的是 ;气体X的化学式为 。
(2)滤渣是废弃物,水洗的目的是 ;检验滤渣是否洗净的试剂若是用碳酸钠溶液,则利用的反应的化学方程式为 ;试剂若是用硝酸银溶液 ,则可能生成的沉淀的化学式为 ,此沉淀的直接来源可能有 个。
(3)操作Y的名称是 ,滤液2中可循环利用的物质除水外还有 。
(4)洗涤氯化钡制品最适宜的洗涤剂是 。(填字母)
A.30℃水 B.30℃饱和氯化钠溶液 C.30℃饱和氯化钡溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(8分)同学们对实验“煅烧石灰石”展开深入探究。
资料:石灰石中的杂质高温不分解且不与稀盐酸反应
(1)为证明石灰石已分解,三位同学设计方案如下:
Ⅰ.甲同学按图一所示进行实验(煤气灯亦能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式 。
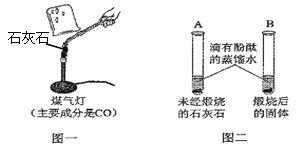
II.乙同学按图二所示进行试验,观察到B中液体变 色,A实验的作用 。
III.丙同学取一块质量为12g的石灰石煅烧,一段时间后发现固体质量减轻2.2g,证明石灰石已分解。
IV.大家认为甲同学的方案不合理,请分析原因 。
(2)为测定石灰石的纯度,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生2.2g气体,结合上述数据计算:丙所取的这块石灰石中碳酸钙的质量分数是多少?
计算过程写在答卷上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com