
| A. | 探究二氧化硫和水反应可能有硫酸生成 | |
| B. | 探究次氯酸钠( NaClO)和浓盐酸反应时会产生氮气 | |
| C. | 探究铜在酒精灯上灼烧时出现的黑色物质可能是炭黑 | |
| D. | 探究钠与水的反应产生的气体可能是氢气 |
分析 根据进行科学探究时,要有合理的理论依据,不能凭空猜测,二氧化碳为酸性氧化物,可以与水反应生成酸,化学反应前后元素的种类不变,钠和水中含有钠元素、氢元素和氧元素,故生成物中含钠元素、氢元素和氧元素,次氯酸钠( NaClO)和浓盐酸中没有氮元素,反应时不会产生氮气,铜在灼烧时与空气接触,燃料酒精和空气中都含有碳元素进行分析.
解答 解:A、二氧化硫和水反应可能有硫酸生成,也可能有亚硫酸生成,因此有意义,故选项错误;
B、根据质量守恒定律,反应前没有氮元素,反应后也不可能产生氮气,因此没有意义,故选项正确;
C、铜在灼烧时与空气接触,燃料酒精和空气中都含有碳元素,猜测黑色物质可能是炭黑,因此有意义,故选项错误;
D、钠与水的反应产生的气体可能是氧气,根据质量守恒定律还可能是氢气,有意义,故选项错误;
故选:B.
点评 本考点考查了科学探究和质量守恒定律,设计实验方案时,要注意设计的方案是否有探究的意义,有探究意义时,我们才可以进行探究.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
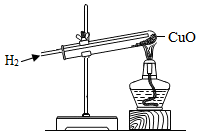 如图所示为实验室用氢气还原氧化铜实验的示意图.
如图所示为实验室用氢气还原氧化铜实验的示意图.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | BaCl2溶液、NaOH溶液、Na2CO3溶液、盐酸 | |
| B. | NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸 | |
| C. | Na2CO3溶液、BaCl2溶液、NaOH溶液、盐酸 | |
| D. | BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com