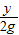将一定质量的镁、铝、铁三种金属的混合物与足量的稀硫酸充分反应后,生成氢气2克,则原混合物质量不可能是( )
A.18克
B.24克
C.28克
D.50克
【答案】
分析:依据对金属与酸反应的规律的认识可知,三种金属中同质量时铝生成的氢气最多,铁生成的氢气最少,因此可采用极端假设的方法对反应的情况进行分析,从而得到金属混合物的取值范围;
解答:解:设生成2g氢气时需要铝的质量是x,铁的质量是y;
2Al+3H
2SO
4═Al
2(SO
4)
3+3H
2↑
2×27 6
x 2g
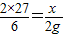
x=18g
Fe+H
2SO
4═FeSO
4+H
2↑
56 2
y 2g

=
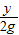
y=56g
所以原混合物质量范围是大于18g小于56g;
故选A.
点评:本题主要考查学生利用化学方程式进行计算的能力.解题的关键是要分析清楚要使金属混合物跟足量稀硫酸反应生成2g氢气,所需的金属的取值范围,主要是采用极端假设的方法完成;

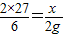
 =
=