
����Ŀ��������һ�ֱ�����Դ�������ÿ����з�����ĵ����ϳɰ������ϳɰ�����ᷢչ��������������˾��ף������Ǻϳɰ��Ĺ�������ͼ��
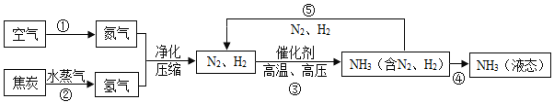
��1����������____���������������������е������������ԼΪ __%��
��2���û�ѧ�������
���������____ ���NH3�е�Ԫ�صĻ��ϼ�______
����__________ ����۵ķ�Ӧ��û�иı������__
��3�����е㲻ͬ��������뿪����������Һ�����뷨��������¶��ک�183��ʱ���ɽ�������N2��O2���롣�����±������ʵķе��жϣ�Ҫ������NH3��N2��H2���뿪�����¶�Ӧ�ÿ�����___�档
���� | H2 | N2 | O2 | NH3 |
�е� | ��252�� | ��195.8�� | ��183�� | ��33.35�� |
��4��ͼ��������Ģ٢ڢ۵ı仯�У��������������仯�Ĺ�����____����������ѭ��ʹ�õ�������___�������ƣ���
��5��д��N2��H2��Ӧ����NH3�Ļ�ѧ����ʽ_________��
���𰸡������ 78 2H2 ![]() He N��H -33.35 �� ���������� N����3H2
He N��H -33.35 �� ���������� N����3H2 ![]() 2NH3
2NH3
��������
1���������ɵ�����������������̼����ɵĻ��������е������������ԼΪ78%��
��2�����ӵı�ʾ��������ȷ��д���ʵĻ�ѧʽ����ʾ����÷��ӣ����仯ѧʽǰ������Ӧ�����֣�������������ӱ�ʾΪ2H2����NH3����Ԫ�صĻ��ϼ�Ϊ+1�ۣ����ݻ�������Ԫ�صĻ��ϼ۴���Ϊ�㣬�ɵõ�Ԫ��Ϊ-3�ۣ�Ԫ�ػ��ϼ۵ı�ʾ������ȷ��������������Ҫ�����Ԫ�صĻ��ϼۣ�Ȼ�����仯ѧʽ��Ԫ�ص��Ϸ��������ź����ֱ�ʾ����������ǰ�������ں����Ա��NH3�е�Ԫ�صĻ��ϼ� ![]() �������ǵ�ԭ�ӷ��ӣ���Ԫ�ط��ſ���ֱ�ӱ�ʾ����ѧʽΪ��He�����ݹ������̿�֪������۵ķ�Ӧ�ǵ����������ڸ��¸�ѹ�����������������ɰ�����û�иı�����ǵ�ԭ�Ӻ���ԭ�ӣ�����Ϊ��N��H��
�������ǵ�ԭ�ӷ��ӣ���Ԫ�ط��ſ���ֱ�ӱ�ʾ����ѧʽΪ��He�����ݹ������̿�֪������۵ķ�Ӧ�ǵ����������ڸ��¸�ѹ�����������������ɰ�����û�иı�����ǵ�ԭ�Ӻ���ԭ�ӣ�����Ϊ��N��H��
��3�������¶��ک�183��ʱ���ɽ�������N2��O2���룬���Ҫ������NH3��N2��H2���뿪�����¶�Ӧ�ÿ����ک�33.35������������N2��H2����̬��NH3����Һ̬��
��4����Ӧ���Ǵӿ����з���������Ĺ����У������������͵����ķе㲻ͬ�����������û�����������ʣ����������仯����Ӧ��̼��ˮ������Ӧ���������ɣ��仯�����������������ɣ����ڻ�ѧ�仯����Ӧ���ǵ����������ڸ��¸�ѹ�����������������ɰ������仯�����У������������ʣ����ڻ�ѧ�仯��ͼ��������Ģ٢ڢ۵ı仯�У��������������仯�Ĺ������٣����ݹ������̿�֪����������ѭ��ʹ�õ������ǵ�����������
��5�����ݹ������̿�֪�������������ڸ��¸�ѹ�����������������ɰ�������ѧ����ʽΪ��N����3H2 ![]() 2NH3��
2NH3��


 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д� Сѧ��ѧ������ѿڶ���ϵ�д�
Сѧ��ѧ������ѿڶ���ϵ�д� ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�о������������ڳ�ѹ�¾Ϳ�Һ��ΪҺ����Һ�����������������ȼ�ϣ���ȼ��ʱ����Ҫ��ӦΪ4NH3+3O2![]() 2X+6H2O������˵���в���ȷ���ǣ� ��
2X+6H2O������˵���в���ȷ���ǣ� ��
A. �����ڳ�ѹ��Һ���������仯
B. X�Ļ�ѧʽΪN2
C. Һ�����п�ȼ�����ڻ�ѧ����
D. Һ�����ڻ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1909�꣬��ѧ�ҹ����õ����������ڸ��¸�ѹ�������״κϳ��˰�������Ӧԭ����N2+3H2![]() 2NH3���������п�ȼ��,ȼ��ʱ�������ߡ������ѧ�ҷ����ô����ڳ����¾��ܺϳɰ���,ʹ��������Ϊ������ܵ���һ����Դ��
2NH3���������п�ȼ��,ȼ��ʱ�������ߡ������ѧ�ҷ����ô����ڳ����¾��ܺϳɰ���,ʹ��������Ϊ������ܵ���һ����Դ��
��1�������е�Ԫ�صĻ��ϼ���___�������е�Ԫ������Ԫ�ص�������Ϊ____��
��2��������������ģ��ͼ��ʾ�ϳɰ����Ĺ��̣���ӷ�Ӧ��ʼ����ɵ�����˳����_____������ĸ��ʾ����

��3������ȼ��ʱ���ܻ����ɵ����������Ⱦ����������һ�������£�����ȼ��ȴû���κ���Ⱦ���÷�Ӧԭ���ǣ�4NH3+3O2![]() 2X+6H2O������X��________��
2X+6H2O������X��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ��д���йط�Ӧ�����ֱ���ʽ��������д�����ʵĻ�ѧʽ��
��1�������ڿ�����ȼ�գ�____________________��
��2����˿����������ȫȼ�գ�____________________��
��3�����ڿ�����ȼ�գ�____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ����ʽ��д��ȷ����
A. H2O2![]() H2��+O2�� B. H2O+CO2
H2��+O2�� B. H2O+CO2![]() H2CO3
H2CO3
C. H2O![]() H2��+O2�� D. 3Fe+2O2
H2��+O2�� D. 3Fe+2O2![]() Fe3O4
Fe3O4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС�����������Ŀ����ͺ����������������ʵ��̽����
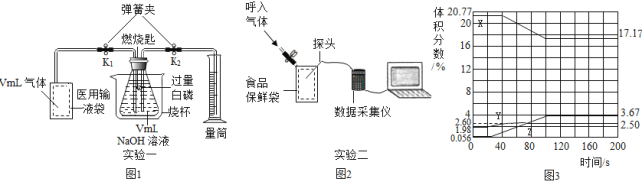
��������⣩��������Ŀ�����������������ʲô��ͬ��
�����ϣ��ٰ����Ż��Լ40�棻��ͨ�������£�����������Һ����ײ���Ӧ������������Һ�������ն�����̼���塣
��ʵ�������ʵ��һ������ͼ1��
��1������װ�������Ժ�װ���Լ���ҽ����Һ�����ռ�VmL������
��2�����ɼ�_______�����������п���ȫ��������ƿ�У�������Ͳ���ռ���Һ��V1mL���ɴ˲�ÿ�����_____�����Ϊ______mL��
��3���رյ��ɼ�K1��K2������_____������������������ʹȼ�ճ��ڵİ���Ѹ��ȼ�գ���Ӧ�Ļ�ѧ����ʽΪ________����ַ�Ӧ����ȴ�����£���K2����Ͳ��ʣ��Һ��ΪV2mL���ɴ˲�������ڿ�������ռ����������ɱ�ʾΪ_____��
ʵ���������ͼ2��
��4���Ѳⶨ������������̼��ˮ�����Ĵ���������ʳƷ���ʴ���Ȼ������ں������塣�ɼ������ݾ�������ͼ3��ʾ����ʾ������������仯��_____�����X������Y����Z������Y�����������60s֮����С��ԭ����_________��
�����ݴ�������5��ʵ����У�200sʱû�б��ɼ����ݵ�����������������������Ϊ____%��
�������뷴˼����6����ʵ���������������������������ȣ�����ϵIJ�����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ж����˹�Ӧ��,����Ϊ��7��,�����˹�˾�����ܴ����ʧ���ҹ�Ӧ��ǿ�����з�оƬ����������ͼΪ�ྦྷ��������ҵ�����ߴ��������ʾ��ͼ��
![]()
��SiO2+2C ![]() Si+2CO��
Si+2CO��
��Si+3HCl![]() SiHCl3 +H2��
SiHCl3 +H2��
��SiHCl3+H2 ![]() Si+3HCl
Si+3HCl
�ŷ�Ӧ�ٵĻ�����Ӧ����Ϊ_____________________��
�������Ʊ����̱���ﵽ��ˮ��������H2��ԭ SiHCl3������������O2,��������ĺ����________________________________��
��Ϊ�˴ﵽ��ɫ��ѧ�ͽ�Լ��Դ��Ŀ�ģ�����������ij��������Ҫѭ��ʹ�ø����ʵĻ�ѧʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�����������ˮ���ұ��IJ������ݡ�
��������ˮˮ�ʳ��������Ŀ����ֵ�����֣�
��Ŀ | ��ֵ |
ɫ�� | ������15�ȣ������ó���������ɫ |
���Ƕ� | ������1�ȣ���������²�����5�� |
pH | 6.5��8.5 |
��Ӳ�ȣ���CaCO3�ƣ� | 450mg/L |
�� | 0.2mg/L |
�� | 0.3mg/L |
������ | 250mg/L |
�����С�����ָ����_______��ѡ����ʡ���Ԫ�ء���ԭ�ӡ�)��
��������Ӳˮ�����ķ�����________ ������֪����ˮ��Ӳˮ������ˮ���ɼ���________ �����顣
��Cl2��ClO2����������ˮ��������������Ԫ�صĻ��ϼ۷ֱ���____________��
��1L�ϸ����������ˮ�У�����CaCO3����Ӳ�ȣ����Ԫ�صĺ���������____mg/L��
��ʵ����������ˮ��ͨ��ֽ⣬���������������������ԼΪ_______����Ӧ�Ļ�ѧ����ʽΪ ��________��
�������ϵ���ˮ������Ȼ�ܴ���ˮ���٣�����ˮ��Դ��ÿ������Ӧ�������κ����������о�һ����Լ��ˮ�ĺ������飺_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����ʵ��Ϊ������ѧ�ƣ���ͼ��ʾʵ�鶼��̼�йأ��ش��й����⣺

��ʵ����м��к���ľ̿������ǯӦ____����ʢ�������ļ���ƿ�У�������������١���
��Ϊ��֤��ʵ����������������IJ����ǣ�____��
��ʵ������Թ�A�ڷ�Ӧ��ѧ����ʽΪ��____��
����������ʵ���У�ľ̿���ֳ��Ļ�ѧ����____��
��ͼ2��ʾ���ȸ�a��c��֧��ͬ�Ĵ��Թ��г�������ɫ��NO2���壬Ȼ��ֱ���a��c��֧�Թ��м���������ȵ�������ʯī�ͻ���̿����������������һ��ʱ����ɼУ����۲쵽��������c�Թ���____���ձ��е�ˮ____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com