
【题目】下图表示初中常见化学反应中溶液的颜色变化,其中x表示稀盐酸或稀硫酸,则下列叙述错误的是
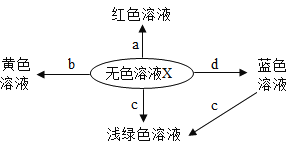
A.a不可能是无色酚酞试液
B.b可能是氧化物
C.c不可能是氧化物
D.d可能是单质
科目:初中化学 来源: 题型:
【题目】元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
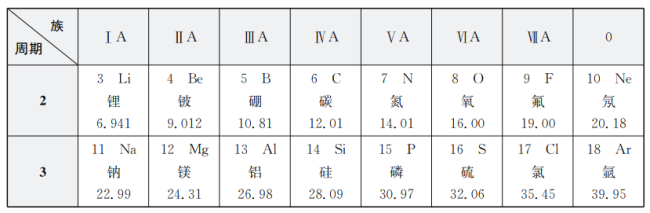
(1)请从上表中查出关于硼元素的一条信息:______。
(2)第3周期(横行)中属于金属元素的是______(填一种),其阳离子是______。
(3)第11号元素与第17号元素组成的化合物是______,构成该物质的微粒是______(填“分子”“原子”或“离子”)。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是______(填序号)。
a C和Ne b Be和Mg c Al和Si d F和Cl
(5)第9号氟元素和氢元素形成的化合物的水溶液氢氟酸(HF),可用于玻璃雕刻,其主要原理是氢氟酸与玻璃的主要成分二氧化硅SiO2发生反应,生成四氟化硅气体(SiF4)和水,该反应的化学方程式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列装置回答问题
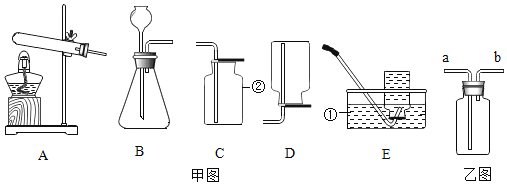
(1)写出标号仪器名称:①_____ ②_____
(2)实验室用氯酸钾和二氧化锰混合制取并收集氧气,可选择的装置组合是_____(填字母),写出该反应的化学方程式为_____;在此反应过程中,二氧化锰在反应前后固体混合物中的质量分数将_____(填“变大”、“变小 ”或“不变”)。
(3)若先在乙图集气瓶中装满水,用排水法收集氧气,氧气应从_____(“a”或“b”)端通入。
(4)选用B装置制取二氧化碳时,长颈漏斗的作用是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲乙两种固体物质的溶解度曲线。据图回答:[来源
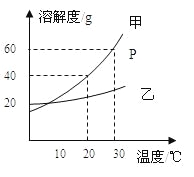
(1)P点的含义是__________________________。
(2)20℃时要使接近饱和的甲溶液变成饱和溶液,可采用的方法有 _________(写出一种)
(3)当甲中含有少量乙时,可采用____________的方法提纯甲 。
(4)30℃时,将40g甲物质放入盛有50g水的烧杯中,所得溶液溶质的质量分数为______;若将烧杯内物质升温到50℃(不考虑水蒸发),溶液中变化的是_____(选填A、B、C、D)
A、溶剂的质量 B、溶液的质量C、溶质的质量分数D、以上都不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】新药左旋氧氟沙星(C18H20FN3O4)可用于治疗敏感菌引起的呼吸道感染,其说明书中部分内容如图。

(1)左旋氧氟沙星由______________种元素组成。
(2)左旋氧氟沙星中氧元素的质量分数是_____________(精确到0.1%)。
(3)成人呼吸道感染患者,一个疗程最少应服用左旋氧氟沙星______________g。
(4)从保存方法看,左旋氧氟沙星可能具有_______________的化学性质。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线。下列有关该实验事实的说法正确的是( )
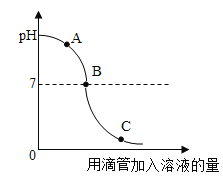
A.该实验是将氢氧化钠溶液滴入盐酸中
B.B点表示盐酸和氢氧化钠恰好完全反应
C.C点时的溶液能使酚酞试液变红
D.A点时,溶液中的溶质有氯化钠和氢氧化钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学配制25g 3%的NaCl溶液,整个操作过程如图所示。
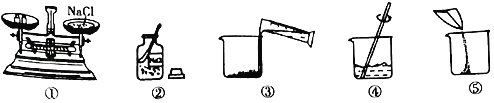
回答下列问题:
(1)配制溶液的正确操作顺序为_____(填序号),其中操作错误的是_____(填序号)
(2)用量筒量取液体时,读数时视线要与量筒内_____保持水平。
(3)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在探究金属与酸的反应时,发现铜片与20%的硫酸溶液不反应。有同学提出疑问“在一定条件下铜与硫酸能否发生反应”,并进行了系列实验。
(查阅资料)SO2能让红色的品红溶液褪色,能被NaOH溶液吸收。
(进行实验)(夹持仪器略)
实验1:初步实验(所用溶液均为硫酸溶液)
实验序号 | 1﹣1 | 1﹣2 | 1﹣3 | 1﹣4 | 1﹣5 |
装置 |
|
|
|
|
|
主要现象 | 铜片a附近溶液逐渐变蓝,铜片b附近产生无色气泡。 | 无明显现象 | 无明显现象 | 无明显现象 | 铜片溶解,溶液变蓝,生成有刺激性气味的无色气体 |
经检验实验1﹣1中产生的气体是氢气。
实验2:在实验1﹣5的基础上深入探究,装置如图。

(解释与结论)
(1)实验1﹣1中,能证明铜发生反应的现象是_____。
(2)实验1中,欲得出“升高温度可使铜与硫酸反应”需对比的实验是_____(填实验序号)。
(3)补全实验1﹣5和实验2中铜与硫酸反应的化学方程式:![]() _____
_____
(4)与实验1﹣5相比,实验2的优点有_____(写出一条即可)。
(5)通过上述实验能得出的结论是_____。
(反思与评价)
(6)下列说法不正确的是_____。
A 对比实验1﹣2和1﹣5,可得出“增大浓度可使铜与硫酸反应”
B 通电可促进一些化学反应的发生
C 铜与硫酸只能发生一种化学反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】探究小组欲从含有FeCl3、CuCl2的废液中回收金属铜,取一定量的废液样品加入少量铁粉,一段时间后铁粉完全溶解,但未发现红色固体沉积.
出现这种现象的可能原因是 ;
经查阅资料,铁粉在废液中发生两个化学反应:
①2FeCl3+Fe═3FeCl2 ②CuCl2+Fe═FeCl2+Cu
(2)探究小组另取废液,向废液中加入一定且足量的铁粉至充分反应,溶液变为浅绿色,过滤、干燥,称得固体沉积物质量与加入铁粉质量相等.
①固体沉积物质量与加入铁粉质量相等的原因是 ;
②经测定,反应后得到铜的质量为1.6g,其中,反应①消耗铁粉的质量是 ,反应②消耗铁粉的质量是 (计算结果精确到0.1).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com