
【题目】甲、乙、丙三种物质的溶解度曲线如图所示。据图回答:
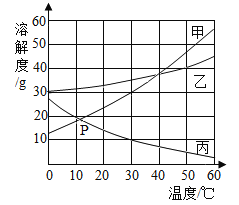
(1)50℃时,乙物质的溶解度是_________g;此温度下,取25g乙物 质溶于50g水中,此溶液为______(饱和或不饱和),此溶液中溶质的质量分数为_________。
(2)30℃时,三种物质的溶解度由大到小的顺序为____________;
(3)20℃10g丙物质溶解在100g水中得到的是不饱和溶液,在不改变溶质质量分数的前提下,如何变为饱和溶液________;
(4)50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃时,析出晶体最多的是_________,所得溶液中溶质质量分数最小的是_____________。
(5)将10℃时甲、乙、丙三种物质饱和溶液的温度升高到30℃时,三种溶液的溶质质量分数由大小关系是___________。
(6)50℃将甲、乙、丙三种物质饱和溶液恒温蒸发掉等质量的水,析出晶体多少顺序是_______。
(7)交点P的含义是__________。
(8)甲和乙两种物质的溶液混合在一起,通常采用_________方法得到甲,若要得到乙,一般采用____________方法。
【答案】40 不饱和 33.3% 乙>甲>丙 升高温度 甲 丙 乙>甲>丙 甲>乙>丙 约12℃时,甲、丙的溶解度相同 降温结晶 蒸发结晶
【解析】
由甲、乙、丙三种物质的溶解度曲线图可知,甲、乙两种物质的溶解度随温度的升高而增大,甲物质的溶解度受温度的影响较大,丙物质的溶解度随温度的升高而减小。
(1)由溶解度曲线可知,50℃时,乙物质的溶解度是40g,则取25g乙物质溶于50g水中,此溶液为不饱和溶液,此溶液中溶质的质量分数为![]() 。
。
(2)由溶解度曲线可知,30℃时,三种物质的溶解度由大到小的顺序为乙>甲>丙。
(3)丙的溶解度随着温度的升高而降低,使接近饱和的丙物质溶液变为饱和,增加溶质、蒸发溶剂均会改变认知质量分数,在不改变溶质质量分数的前提下,可以采用升高温度的方法变为饱和溶液。
(4)甲、乙两种物质的溶解度随温度的升高而增大,丙物质的溶解度随温度的升高而减小,50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃时,甲、乙两种物质有晶体析出,丙没有晶体析出,甲物质的溶解度受温度的影响较大,故析出晶体最多的是甲,在50℃时,三种物质的溶解度大小关系是甲>乙>丙,即在50℃时,三种物质的饱和溶液中溶质的质量分数关系为甲>乙>丙,降温至10℃时,甲和乙的溶液中都会有晶体析出,溶液都还是饱和溶液,在10℃时三种物质的溶解度乙>丙>甲,而由于丙的溶解度随温度的降低而增大,降温至10℃时,它的饱和溶液就会变成不饱和溶液,溶液的组成没有发生改变,溶液中溶质的质量分数不变,10℃时甲的溶解度大于50℃时丙的溶解度,丙的溶液中溶质的质量分数还是最小,故所得溶液中溶质质量分数最小的是丙。
(5)甲、乙两种物质的溶解度随温度的升高而增大,丙物质的溶解度随温度的升高而减小,10℃时,甲、乙、丙三种物质饱和溶液的的质量分数大小为乙>甲>丙,温度升高到30℃时,甲、乙溶液的组成不变,溶质质量分数不变,丙有晶体析出,丙的质量分数变小,故三种溶液的溶质质量分数由大小关系是乙>甲>丙。
(6)50℃时,甲、乙、丙三种物质的溶解度大小为甲>乙>丙,则甲、乙、丙三种物质饱和溶液含水的质量关系为丙>乙>甲,将甲、乙、丙三种物质饱和溶液恒温蒸发掉等质量的水,析出晶体多少顺序是甲>乙>丙。
(7)交点P是甲丙溶解度曲线交点,故含义是约12℃时,甲、丙的溶解度相同。
(8)甲、乙两种物质的溶解度随温度的升高而增大,甲物质的溶解度受温度的影响较大,故甲和乙两种物质的溶液混合在一起,通常采用降温结晶方法得到甲,若要得到乙,一般采用蒸发结晶方法。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】用“侯氏制碱法” 制取的纯碱中常常含有少量的氯化钠。为了测定某纯碱样品中碳酸钠的质量分数,小雯同学称取该样品 5.6g 加入到烧杯中,再向烧杯中滴加稀盐酸至 100g 时,恰好完全反应,称得烧杯中的溶液质量为103.4g。求:
(1) 完全反应产生二氧化碳的质量是___________________________g。
(2) 100g 稀盐酸溶液中溶质的质量分数。___________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下表回答相关问题。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g/100g水) | KNO3 | 13.3 | 31.6 | 63.9 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
①表中两种物质的溶解度相等的温度范围是在___________℃。
②20℃时,硝酸钾的溶解度是31.6 g/100g水,其含义是___________。该温度下,将20gKNO3
放入50g水中,充分搅拌,所得溶液的质量是_______g。要进一步提高该溶液的溶质质量分数,可进行的操作是__________。
③硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是_________ 。
④60℃时,对100g硝酸钾饱和溶液(如A烧杯)进行如下操作,请回答相关问题:

上述溶液中所含溶质的质量D_____E(填“>”或“<”或“=”,下同),溶液不饱和的是___(用A、B、C、D、E填空),溶液B、C、E中溶质质量分数的大小关系是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学用语是学习和研究化学的重要工具。请用适当的化学符号填空
(1)60个碳原子_____。
(2)由 4个磷原子构成的磷分子_____。
(3)构成硫酸铜的阴离子为_____。
(4)标出亚硝酸钠(NaNO2)中氮元素的化合价_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一种自生氧防毒面具,其使用的生氧剂的主要成分是(KO2)。取100g生氧剂放入质量为20g的烧杯中,再向其中加入20g水,使生氧剂KO2全部反应,其充分反应后(4KO2+2H2O═4KOH+3O2↑),称得烧杯及烧杯中物质的总质量为116g,计算(假设杂质不含钾元素且不与稀硫酸反应)
(1)100g生氧剂生成氧气的质量_____;
(2)KO2中钾元素的质量分数为_____;(计算结果精确到 0.1%)
(3)要将烧杯中的溶液完全中和,通过计算,需要溶质质量分数为10%的稀硫酸溶液的质量_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学在老师的指导下,对一瓶出现变质硬化的氢氧化钙固体变质程度进行探究,测定3g样品中含有杂质的质量,设计实验装置(气密性良好)如图1所示.

(1)取3克部分变质的氢氧化钙样品放入烧瓶中.滴入稀盐酸,当观察到 (填实验现象),停止滴加稀盐酸;
(2)实验结束后,量简内进入水的体积如图2所示,其演数为165mL,已知在该实验条件下,生成气体的密度为2gL﹣1,则生成C02气体的质量为 ;(精确到 0.01)
(3)请计算3克变质的氢氧化钙祥品中杂质的质量.(精确到0.01)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有硫酸铵、硝酸铵、氯化铵、尿素[CO(NH2)2]四种氮肥,通过如下图所示步骤进行鉴别。下列说法中正确的是( )
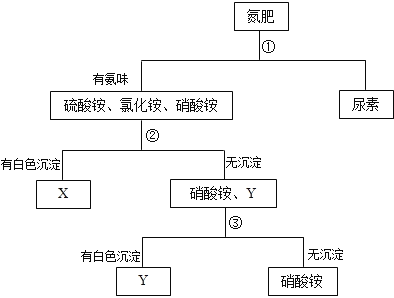
A.通过步骤②得到的白色沉淀是BaSO4,通过步骤③得到的白色沉淀是AgCl
B.步骤①、②、③中所加试剂依次可为NaOH溶液、AgNO3溶液、Ba(NO3)2溶液
C.物质X是氯化铵,物质Y是硫酸铵
D.这四种氮肥氮元素的质量分数由大到小的顺序为尿素>硝酸铵>氯化铵>硫酸铵
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示,下列说法正确的是( )

A. x的值为22
B. 该反应中的生成物是CO2、H2O和O2
C. W由碳、氢两种元素组成
D. W中碳、氢元素原子个数比为1∶4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】汽车是现代生活中不可缺少的交通工具。
(1)汽车电路中的导线大部分都是铜制的,这是利用了铜的延展性和______。
(2)部分汽车使用天然气做燃料,排放的污染物较少。写出天然气主要成分燃烧的化学方程式:______。
(3)汽车中的下列部件和物品属于有机合成材料的是______(填序号)。
A 橡胶轮胎 B 钢板车门 C 纯棉座垫 D 真皮方向盘套
(4)汽车刮蹭严重时要及时补漆,其目的是______。
(5)夏天汽车轮胎气太足易爆胎。请从微观角度解释______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com