
某同学可用下图装置粗略地测定 空气中氧气的体积分数。图中烧杯上方玻璃管(预先固定好)中部有一可左右滑动的活塞,活塞左端管内密封有空气,活塞右端的玻璃管口跟空气连通,实验开始前活塞处在刻度5cm处(生石
空气中氧气的体积分数。图中烧杯上方玻璃管(预先固定好)中部有一可左右滑动的活塞,活塞左端管内密封有空气,活塞右端的玻璃管口跟空气连通,实验开始前活塞处在刻度5cm处(生石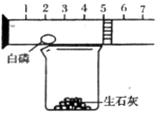 灰溶于水要放热)。
灰溶于水要放热)。
(1)向烧杯内加入适量水,与生石灰反应的目的是 。
(2)可观察到玻璃管内开始发生的现象:
①白磷(过量) ;
②实验结束,恢复至常温后,活塞应停在约 cm 处。
据此可得出的结论是 。
科目:初中化学 来源: 题型:
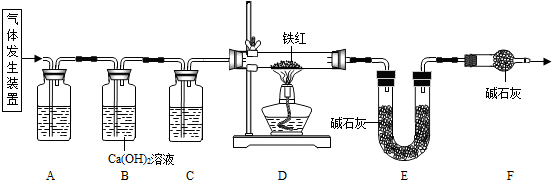
 碳,该反应装置通过粗铜丝调节能随时控制反应的发生.
碳,该反应装置通过粗铜丝调节能随时控制反应的发生.
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题


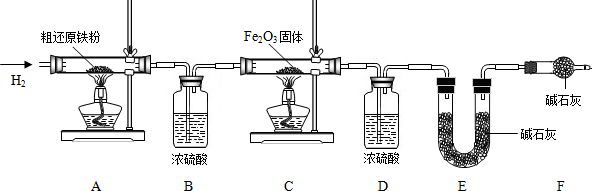
 x Fe+y H2O,Fe3C+2H2
x Fe+y H2O,Fe3C+2H2 3Fe+CH4.
3Fe+CH4.
 3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响).
3CO2+6H2O+8Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响).查看答案和解析>>
科目:初中化学 来源:江苏省模拟题 题型:实验题


 x Fe + y H2O,Fe3C + 2H2
x Fe + y H2O,Fe3C + 2H2 3 Fe + CH4。
3 Fe + CH4。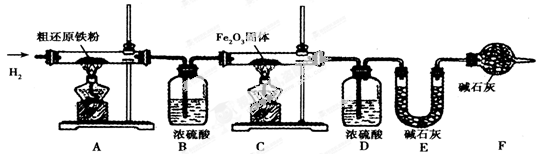
 3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。
3 CO2 + 6H2O + 8 Fe(假设每步反应都完全,且不考虑装置内原有空气对测定结果的影响)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com