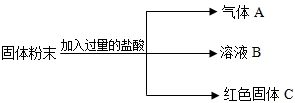
有一包固体粉末,可能含有硫酸钾、碳酸钙、硝酸钙、氯化钡中的一种或几种.取少量该固体粉末加到足量的水中,充分振荡,得到白色沉淀,向该白色沉淀中加入稀硝酸,只有部分溶解,且有气体放出.请你回答:
(1)该固体粉末中一定含有________.
(2)写出实验过程中发生的反应的化学方程式:
①________;
②________.
解:因取少量该固体粉末加到足量的水中,有白色沉淀,所以我们可以确定混合物中可能存在碳酸钙.因碳酸钙不溶于水.白色沉淀也可能是反应生成的.在沉淀中滴加稀硝酸,沉淀部分溶解,说明沉淀中一定含有碳酸钙,同时在沉淀中还含有硫酸钡.要出现硫酸钡,一定在混合物中含有硫酸钾和氯化钡.这两种物质在溶液中反应生成硫酸钡.而混合物中的硝酸钙,我们不能确定有还是没有.
故答案为:
(1)硫酸钾、碳酸钙、氯化钡
(2)①K2SO4+BaCl2=BaSO4↓+2KCl
②CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O
分析:在推断所给的混合物的组成时,可以首先将混合物放入水中,根据出现的现象来判断有哪些物质,然后再根据往所得的沉淀中加其它试剂,来确定没有哪些物质.
点评:在初中阶段我们所学过的物质中,只有硫酸钡和氯化银即不溶于水,也不溶于酸.所以我们在做题时,若出现不溶于水也不溶于酸的沉淀,那么我们一定会判断是这两种物质.



 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案