
【题目】化学与生活、生产息息相关,请运用化学知识回答以下问题.
(1)贴在门上的春联,天长日久之后,红纸褪色,字迹却依旧清晰.其中字迹清晰的原因是 .
(2)古墓出土的黄金器皿、现实生活中的铝合金门窗都具有很好的抗腐蚀性能.其中,铝合金具有抗腐蚀性能的原因是(用化学方程式表示) .
(3)2017年4月我国可燃冰试采取得成功,可能就此解决世界能源短缺问题.试写出可燃冰的主要成分燃烧的化学方程式 .
(4)一次实验中,芊卉同学不小心将浓硫酸沾到衣服上,正确的处理方法中,第二步处理方法的原理是(用化学方程式表示) .
(5)在人体组织里,葡萄糖为人体提供能量的原理(用化学方程式表示) .
【答案】
(1)在常温下,碳的化学性质稳定
(2)4Al+3O2=2Al2O3
(3)CH4+2O2![]() CO2+2H2O
CO2+2H2O
(4)H2SO4+2NaHCO3=Na2SO4+2H2O+2CO2↑
(5)C6H12O6+6O2![]() 6CO2+6H2O
6CO2+6H2O
【解析】解:(1)在常温下,碳的化学性质稳定,所以贴在门上的春联,天长日久之后,红纸褪色,字迹却依旧清晰;(2)铝和空气中的氧气反应会生成致密的氧化铝薄膜,阻碍铝的进一步反应,化学方程式为:4Al+3O2=2Al2O3;(3)甲烷和氧气在点燃的条件下生成水和二氧化碳,化学方程式为:CH4+2O2 ![]() CO2+2H2O;(4)不小心将浓硫酸沾到衣服上,正确的处理方法是:先用大量水冲洗,然后涂上3%﹣5%的碳酸氢钠溶液,碳酸氢钠和硫酸反应生成硫酸钠、水和二氧化碳,化学方程式为:H2SO4+2NaHCO3=Na2SO4+2H2O+2CO2↑;(5)葡萄糖和氧气在酶的催化作用下反应生成水和二氧化碳,化学方程式为:C6H12O6+6O2
CO2+2H2O;(4)不小心将浓硫酸沾到衣服上,正确的处理方法是:先用大量水冲洗,然后涂上3%﹣5%的碳酸氢钠溶液,碳酸氢钠和硫酸反应生成硫酸钠、水和二氧化碳,化学方程式为:H2SO4+2NaHCO3=Na2SO4+2H2O+2CO2↑;(5)葡萄糖和氧气在酶的催化作用下反应生成水和二氧化碳,化学方程式为:C6H12O6+6O2 ![]() 6CO2+6H2O.
6CO2+6H2O.
所以答案是:(1)在常温下,碳的化学性质稳定;(2)4Al+3O2=2Al2O3;(3)CH4+2O2 ![]() CO2+2H2O;(4)H2SO4+2NaHCO3=Na2SO4+2H2O+2CO2↑;(5)C6H12O6+6O2
CO2+2H2O;(4)H2SO4+2NaHCO3=Na2SO4+2H2O+2CO2↑;(5)C6H12O6+6O2 ![]() 6CO2+6H2O.
6CO2+6H2O.
【考点精析】解答此题的关键在于理解金属材料的选择依据的相关知识,掌握黑色金属:通常指铁、锰、铬及它们的合金.重金属:如铜、锌、铅等;有色金属轻金属:如钠、镁、铝等;有色金属:通常是指除黑色金属以外的其他金属,以及对书写化学方程式、文字表达式、电离方程式的理解,了解注意:a、配平 b、条件 c、箭号.


科目:初中化学 来源: 题型:
【题目】下列有关原子、分子、离子和元素的说法正确的是( )
A.原子是不可分割的实心球体B.分子是化学变化中的最小微粒
C.离子是由原子得到电子形成的D.元素化学性质与原子的最外层电子数关系密切
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水蒸气通过炽热的焦炭可以得到水煤气(主要成分是CO和H2),化学方程式为C+H2O(气) ![]() CO+ H2 ,
CO+ H2 ,
(1)该反应是反应(填基本反应类型)。
(2)某兴趣小组的同学在实验室模拟了水煤气的制备,并设计实验验证水煤气中含有CO和H2。
【查阅资料】白色的无水硫酸铜遇水会变成蓝色。
【设计实验】甲同学设计的实验装置如下图所示:
写出实验现象:B中固体 , C中固体变蓝,D中溶液。
(3)【改进实验】乙同学认为要想达到实验目的,在装置A、 B之间还需增加装置F、G(如图所示),其中F的作用是 , G的作用是。
(4)【拓展探究】CO和H2的混合气在工业上可用于合成一系列化工原料和新型燃料,还可用于冶炼某些金属。
①“绿色化学”能实现零排放(即反应物中的原子利用率达到100%)。根据零排放的要 求,不可能以CO和H2为原料合成的有机物是(填字母)。
A.甲醇(CH3OH) B.乙醇(C2H5OH) C.甲醛(CH2O) D.乙酸(CH3COOH)
②若用CO和H2的混合气冶炼铁,混合气所起的作用是。
铁元素可以形成3种氧化物,分别是Fe2O3、Fe3O4 和FeO(黑色)。下图所示实验中,黑色粉末可能为一种或几种铁的氧化物,充分反应至铁的氧化物全部转化为铁,装置I的增重为3.6g,装置J的增重为6.6g,假设每一步吸收都是完全的,黑色粉末为。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是实验室模拟工业炼铁的装置图.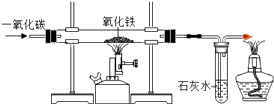
(1).分别写出硬质玻璃管内产生的现象反应的化学方程式
(2)实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸。检验装置中的空气已排尽的方法是。
(3)高炉炼铁中,焦炭的两个作用是(用化学方程式表示)。
(4)用含氧化铁80%的赤铁矿200t,可炼制含杂质2%的生铁吨
(5)某合金6 g与足量的稀硫酸充分反应后,如果生成0.2 g氢气,该合金中的金属可能是
A.Zn 和Fe
B.Cu和Ag
C.Zn和Cu
D.Mg 和Al
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】电石(主要成分是CaC2)是制取乙炔(C2H2)的重要原料。
(1)用电石制取乙炔的化学方程式为CaC2+ =Ca(OH)2+C2H2↑。乙炔在氧气中燃烧,伴随着的能量变化表现为 , 所以乙炔可用于照明、焊接及切割金属。
(2)电石制取乙炔后产生的灰浆可用来制备KClO3晶体。流程如下:
①下列有关过滤的说法正确的是(填字母)。
A.在化学实验中过滤是分离混合物的常用方法
B.使用的玻璃仪器包括长颈漏斗、烧杯、玻璃棒
C.玻璃棒的末端要轻轻地斜靠在单层滤纸的一边
D.过滤器中的液面始终要低于滤纸的边缘
②常温下有关物质的溶解度如下表所示:
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
上述流程中,向Ca(ClO3)2、CaCl2溶液中加入KCl,KCl与(填化学式)发生了复分解反应,得到KClO3晶体。
③Ⅱ中析出晶体后的母液是KClO3的(填“饱和”或“不饱和”)溶液,写出母液中所有溶质的化学式。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】环境问题是全球共同关注的问题,下列措施和理由之间,因果关系不正确的是( )
A.限制生产含磷洗衣剂--防止湖海出现“赤潮”
B.严禁排放未经处理的有毒工业废水--防止水土流失
C.不允许焚烧农作物秸秆--防止污染空气
D.垃圾分类--防止环境污染,废物利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com