
【题目】自来水消毒过程涉及到下列甲和乙两个化学反应,其反应的微观过程如下所示:
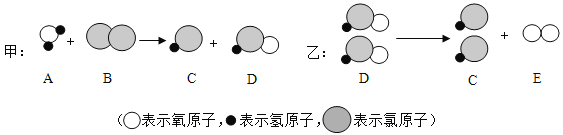
下列说法正确的是( )
A. 两个反应的反应前后的物质都是混合物 B. 物质D属于氧化物
C. 实验室可用水和二氧化锰的混合物制取E D. 乙是分解反应
 考前必练系列答案
考前必练系列答案科目:初中化学 来源: 题型:
【题目】结合以下常用实验仪器(或装置)的示意图,回答相关问题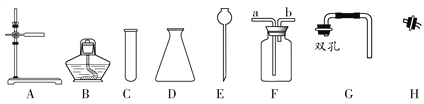
(1)写出下列仪器的名称:D_________ 、E________________ 。
(2)实验室用高锰酸钾制取氧气,用如图仪器组装一套制气的发生装置,除选用图C、H外,还需要选择的仪器是____;反应的化学方程式为_____________,若用F收集氧气,气体应从_____(“a”或“b”)端通入。
(3)若用过氧化氢制取氧气,用如图仪器组装一套制气体的发生装置,则应选择_____(填编号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(7分)将5%的NaOH溶液逐滴加入到109稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示。
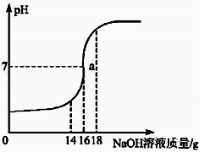
试回答:
(1)a点溶液中大量存在的离子有 。
(2)当恰好完全反应时,消耗NaOH溶液的质量为 。
(3)计算稀盐酸中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A~H八种物质均为初中化学常见物质,A、B、E、F为不同类别的化合物,B、D、G为氧化物,B为常用食品干燥剂,D在常温下为液态,E为常用洗涤剂,G、H为无色气体。F为胃酸的主要成分。A、B、E放入水中能使酚酞变红,下图是它们之间的关系 (部分反应物和产物已省略;“→”表示转化,“-”表示相互反应),请回答:
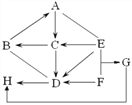
(1)写出下列物质的化学式:B是______;F是_______。
(2)固态物质A的俗名为________。
(3)写出B与D反应的化学方程式___________,此反应属于_____反应(填基本反应类型)。B和D的反应_______(填“放热”或“吸热”)。
(4)写出G→H的化学反应方程式__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验探究是学习化学的重要方法。
(1)化学兴趣小组的同学足量的锌技加入到浓硫酸a中.发现有大量的气泡放出,他们対气体的成分进行了探究。
【提出问题】锌粒加入浓硫酸后生成的气体是什么?
【查阅资料】①浓硫酸能与锌反应,但不产生氢气,也不会产生氧气;
②SO2有刺激性气味,易溶于水,能使品红(一种红色色素)溶液褪色。
【提出猜想】甲:气体是H2;乙:气体是SO2;丙:气体是SO2和H2;
【实验探究】为了验证上述猜想。同学们在老师的指导下设计了如下图的装置(部分夹持器材略去,假设每个能发生的反应都完全进行)进行探究:
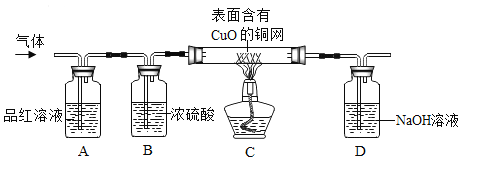
①实验开始后,观察到A中品红溶液褪色,证明气体中含有____。
②B装置的作用是____。
③C装置在点燃酒精灯加热之前应先通一段时间的气体,目的是__;加热一段时间后,观察到_____,证明气体中含有H2。
【讨论】
④锌和浓硫酸反应生成硫酸锌、水和二氧化硫,为什么在反应过程中又产生了氢气呢?用文字简述原因:____。
⑤锌与浓硫酸和稀硫酸反应都可以产生硫酸锌,如果需要制取硫酸锌,用锌与稀硫酸反应的优点是____(任填一种合理的答案)。
(2)碳酸氢钠(NaHCO3)俗称“小苏打”,在生活中用途广泛.某化学实验小组的同学对碳酸氢钠的性质进行探究.
【探究实验1】碳酸氢钠溶液的酸碱性
用试管取适量碳酸氢钠溶液,滴加酚酞试液,振荡,溶液变浅红色.结论:____.
【探究实验2】能与酸反应
取适量碳酸氢钠加入试管中,滴加稀盐酸,再把燃着的木条迅速伸入试管,木条熄灭,碳酸氢钠和盐酸的化学反应方程式:____.
【探究实验3】能与碱反应
查阅资料:NaHCO3+NaOH═Na2CO3+H2O;氢氧化钙微溶于水.用试管取适量碳酸氢钠溶液,滴加氢氧化钠溶液,无明显现象.(提示:可以选择CaCl2溶液做试剂,通过证明有Na2CO3生成,从而证明二者发生了反应)如图,两位同学分别进行了甲、乙两个实验.回答下列问题: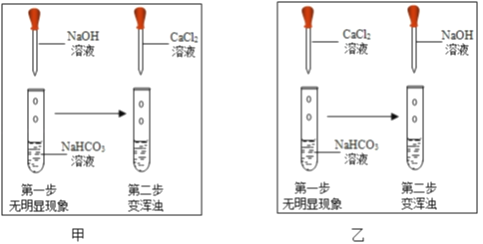
比较甲、乙两个实验的目的性区别是____;
有同学提出两个实验都不足以证明有Na2CO3生成,其理由是____;要证明有Na2CO3生成,还需要进行的操作是____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】走进“化学村”“化学村”的布局如图:
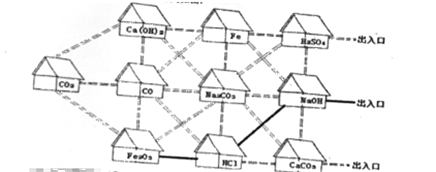
(1)认识“居民”。
①10户“居民”中,俗称火碱的是(写化学式,下同____,属于氧化物的有_______。
②“居民”Fe2O3与HCl反应的化学方程式为_____________。
③氢氧化钠有5户相邻的“居民”:H2SO4、Fe、Na2CO3、HCl、CaCO3,其中不能与它发生反应的是_______。
(2)认识“村中的路”,只有相邻且能相互反应的“居民”间才是通路,例如,图中涂成黑色实线的是一条从“Fe2O3家”,到达出入口的路,可表示为Fe2O3→HCI→NaOH,请你在图中涂出一条从“CO2家”到达任意出入口的路(用化学式与箭头表示)______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学第二课堂小组利用已学过的知识,准备利用含FeSO4和CuSO4的废水(无其他难溶杂质),从中获得硫酸亚铁晶体,其流程如下图所示:
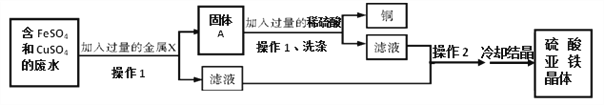
(1)整个流程中,进行了两次操作1,操作1是_____________(填操作名称)。
(2)金属X 是______(填化学符号),其加入废水后发生反应的化学方程式为:____________;固体A中含有__________(填化学符号)。写出固体A与稀硫酸反应的化学方程式为:____________________。
(3)通过冷却结晶法得到硫酸亚铁晶体前需要进行操作2,请问操作2是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁、铜的氧化物能与氢气、一氧化碳和氨气(NH3)等具有还原性的气体反应生成金属单质,某研究性学习小组设计实验进行系列探究。
(-)探究氨气(NH3)与氧化铜的反应
资料一1
①实验室常用浓氨水和生石灰混合的方法制取氨气:CaO+NH3·H2O=Ca(OH)2+NH3↑。
②碱石灰和浓硫酸是常用的干燥剂,浓硫酸能与氨气反应
③Cu20是一种红色固体,能与稀硫酸反应:Cu2O+H2SO4=Cu+CuSO4+H2O。
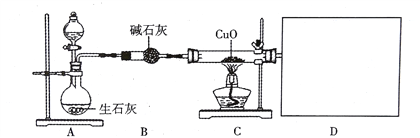
(1)小组同学按图设计组装好仪器,装入药品前应进行的实验操作是_______
(2)A中锥形瓶内发生的反应为___________反应(填“放热”或“吸热”)。
(3)C中玻璃管内氨气与氧化铜在加热条件下完全反应生成铜、水和一种气体单质X,反应的化学方程式为___,反应过程中氨气也可能将氧化铜还原为Cu2O。反应一段时间后,C中固体全部变为红色,取反应后固体少许于试管中,加入足量的稀硫酸,观察到溶液呈_____说明红色固体中含有Cu2O,该红色固体的成分是_____(写出所有可能)。
(4)气体X的密度和空气接近,难溶于水,上图D处欲用下图装置①②③收集较纯净的气体X
并测其体积,装置的连接顺序是_________.

(二)探究一氧化碳与铁的氧化物反应
【资料二】
①Fe2O3·xH2O在温度为110℃时分解为Fe2O3和H2O,FeCO3在282℃时分解为FeO和CO2。
②温度高于500℃时铁的氧化物才能被CO还原。
③用CO还原Fe2O3炼铁的过程大致分为三个阶段
阶段1:3Fe2O3+CO![]() 2Fe3O4+CO2
2Fe3O4+CO2
阶段2:Fe3O4+CO![]() 3Fe++CO2
3Fe++CO2
阶段3:FeO+CO![]() Fe+CO2
Fe+CO2
(5)已知铁锈的成分为Fe2O3·xH2O和FeCO3由此可知:铁生锈过程中,空气中的氧气、水和____都参与了反应.
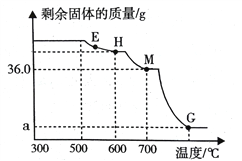
(6)小组同学将铁锈在300℃热分解的产物继续分阶段升温,通人CO还原铁的氧化物。剩余固体质量随温度变化的曲线如下图所示。E点固体的成分是_____.计算图中G点对应的a的值,写出计算过程_____。
(7)金属矿物资源储量有限且不可再生,为防止铁制品生锈,可以采取____________的措施。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类文明与社会进步同金属材料关系密切.
(一)金属的广泛应用
(1)钢铁材料通常分为生铁和钢,这两种铁合金的主要区别就在于_________,写出成语“百炼成钢”中发生反应的化学方程式_________.
(2)高铁酸钾是新型净水剂,化学原理是:4K2FeO4+10H2O=4X+3O2+8KOH,X的化学式是_________ .
(二)金属的锈蚀及防护
(1)下列情况下铁制品最易生锈的是 _________(填序号).
a. 潮湿空气中 b. 干燥空气中 c. 部分浸入食盐水中
(2)铁生锈中存在下列转化:Fe(OH)2 ![]() Fe(OH)3,该反应的化学方程式为_________.
Fe(OH)3,该反应的化学方程式为_________.
(三)铁锈组成分析测定
(1)铁锈中一定含Fe2O3nH2O,可能含FeCO3(FeCO3和稀盐酸的反应与CaCO3相似)),在某铁锈样品中加稀盐酸,_________(填现象),证明不含FeCO3.
(2)另取23.2g只含Fe2O3nH2O的上述铁锈样品,按下图装置实验.
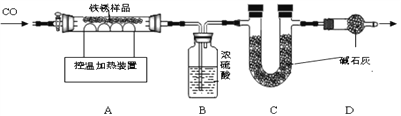
【查阅资料】
①浓硫酸具有吸水性,碱石灰能吸收水和二氧化碳气体.
②在110℃时,Fe2O3nH2O完全分解为Fe2O3和H2O.
③500℃时Fe2O3才开始被还原,且温度不同时产物可能是Fe3O4、FeO(黑色)、Fe.
(3)向装置中加入铁锈样品前,须进行的操作是________.
(4)实验时,先通入CO的目的是 _________ .
(5)当加热超过500℃时,观察到A中的现象是_________.
(6)下表为加热至700℃时所测数据,下图为A中固体质量和加热温度关系图
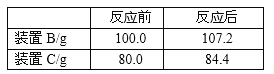

回答下列问题
①Fe2O3nH2O中n的值为_________,图中m的值为_________.
②若无装置D,则所测n的值_________(填“偏大”、“偏小”或“不变”)
③700℃以上时,管内固体产物的化学式为_________;
④该装置有一明显缺陷,如何改进 _________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com