
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
分析 在金属活动性顺序中只要排在前面的金属就能把排在后面的金属从其盐溶液中置换出来,由于金属的活动性Zn>Cu>Ag;用不同的金属置换同种盐溶液,盐中金属先被排在金属活动性顺序中较前的金属置换出来.另外,若有一种金属和多种混合盐溶液反应,最先反应的是最不活泼的那个金属的盐溶液.可以据此分析该题.
解答 解:由金属活动性顺序表可知,金属的活动性Zn>Cu>Ag,向AgNO3溶液中加入一定质量的Zn和Cu的混合粉末,Zn首先与硝酸银溶液反应,Zn反应完成时,Cu再与硝酸银反应.化学方程式为:①Zn+2AgNO3=2Ag+Zn(NO3)2;②Cu+2AgNO3=2Ag+Cu(NO3)2
①当a=1时,则得到的金属为银,Cu和Zn全部反应,硝酸银溶液足量.恰好反应时,溶液中的溶质为硝酸铜和硝酸锌;硝酸银过量时,溶液中的溶质为硝酸铜、硝酸锌和硝酸银,因此,b=2或b=3;故错误;
②但上述两个反应恰好进行完全时,得到的金属的量最大,
设生成银的质量分别为x,y
Zn+2AgNO3=2Ag+Zn(NO3)2 Cu+2AgNO3=2Ag+Cu(NO3)2
65 216 64 216
6.5g x 6.4g y
$\frac{65}{6.5g}$=$\frac{216}{x}$ $\frac{64}{6.4g}$=$\frac{216}{y}$
x=21.6g y=21.6g
因此反应后金属的质量不可能超过21.6g+21.6g=43.2g,
故错误;
③由A知,a=1时,b最大为3,a+b=4;当硝酸银极少时,①反应未进行完,Zn有剩余,则金属为Zn、Cu、Ag,溶液中的溶质为硝酸锌,a=3,b=1,a+b=4,故正确;
④当Zn恰好反应时,得到银为21.6g,当得到的金属质量为20克时,Zn有剩余,①反应未进行完,则金属为Zn、Cu、Ag,a=3,故正确.
因此正确的是③④;
故选项为;D.
点评 本题主要考查了对金属的活动性顺序的应用和金属与盐反应时应该注意的事项,培养学生分析问题、解决问题的能力.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
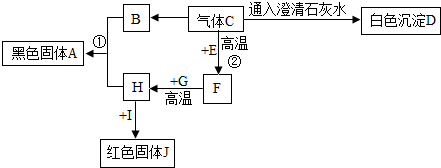
 已知A与B、甲与乙均为初中化学常见的物质,其转化关系如图所示.
已知A与B、甲与乙均为初中化学常见的物质,其转化关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 组别 | 被提纯的物质 | 所选试剂及操作方法 |
| A | KCl固体(MnO2固体) | 溶解、过滤、洗涤、干燥 |
| B | CO2(HCl气体) | 通过盛NaOH溶液的洗气瓶 |
| C | CaO固体(CaCO3固体) | 加入稀盐酸再蒸发 |
| D | NaOH溶液[Ca(OH)2溶液] | 加入适量的Na2CO3溶液再过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com