
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:阅读理解

| ||
| ||
| 工业纯碱标准:(Na2CO3%》) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 固体混合物溶液质量 | 100g | 100g | 100g | 100g |
| 加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的质量 | 4g | m | 10g | 10g |
| 工业纯碱标准:(Na2CO3% ) | |||
| 优等品 | 一等品 | 合格品 | 次品 |
| ≥95 | ≥80 | ≥75 | ≤40 |
查看答案和解析>>
科目:初中化学 来源: 题型:
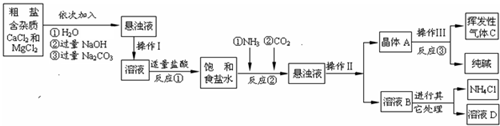
某制碱厂以海水为主要原料生产纯碱(碳酸钠)和其他副产品。
(一)将海水进行处理后获得精盐水。海水中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠
等杂质。其处理的主要流程如下:

(1)加入氢氧化钠溶液的目的是 。
(2)操作Ⅰ所得的沉淀是混合物,其成分有(至少写两种): 。
(3)向滤液中滴加稀盐酸目的是 。
(二)将精盐水制成饱和溶液,先向其中通入足量的氨气,再向其中通入足量的二氧化碳至有大量晶体(碳酸氢钠,NaHCO3)析出;将晶体转移出来后,加热至不再有气体产生,所得固体即为纯碱。
(4)制碱过程中获得的副产品可做化肥,其化学式为 。
组成确定
(5)①称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;② 另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质 (写化学式)。
含量测定
(6)称取纯碱样品21.5g,加入到盛有足量稀盐酸的烧杯中,并不断用玻璃棒搅拌。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。
请通过计算并结合右表判断此纯碱样品等级为 ![]() 品。
品。
计算过程:
总结反思
(7)某同学认为,在上述纯碱含量测定过程中,用玻璃棒不断搅拌,能使测定误差会减小,
其理由是 。
 |
查看答案和解析>>
科目:初中化学 来源: 题型:
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,将得到的红色金属M和金属E进行如下框图所示转化,获得高效净水剂K2EO4.(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):

(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式 。
(2)检验X中阳离子的方法和现象是 。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。试用离子方程式表示溶液变为蓝色的原因: 。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、烧杯、玻璃棒、漏斗、铁架台外,还需要用到的硅酸盐仪器有 (填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图。A中试剂是盐酸。

①装置D的作用 ;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体”? 在这两步之间还应进行的操作是 。
③该实验设计是否还有不足之处?若有请指出并改进,如没有本问可不答。
(6)试说明K2EO4可用作高效净水剂的原因 。
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省盐城市建湖实验中学九年级(下)期中化学试卷(解析版) 题型:解答题

 NH3↑+HCl↑
NH3↑+HCl↑| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 固体混合物溶液质量 | 100g | 100g | 100g | 100g |
| 加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的质量 | 4g | m | 10g | 10g |
| 工业纯碱标准:(Na2CO3% ) | |||
| 优等品 | 一等品 | 合格品 | 次品 |
| ≥95 | ≥80 | ≥75 | ≤40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com