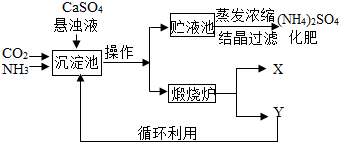
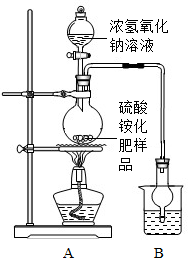
解:【讨论交流】(1)a操作的目的是把混合物分成固体和液体两部分,要用过滤的操作方法.
(2)过滤后得到的固体物质是碳酸钙,在煅烧炉中高温分解生成氧化钙和二氧化碳两种物质,由图示知,后者是可反复利用.
(3)反应物为氨气及二氧化碳和水,生成物为碳酸氢氨,常温下反应,则方程式为:CO
2+NH
3+H
2O=NH
4HCO
3.
【硫酸铵化肥等级测定】(1)碳酸氢氨可与酸反应生成二氧化碳气体,有气泡放出现象,所以可加入盐酸(HCl)、硫酸(H
2SO
4)或硝酸(HNO
3)等判断是否存在.
【实验设计】:(2)①水,②浓HCl,③稀H
2SO
4,④NaOH溶液四种物质中,水不如酸吸收效果好,但盐酸易挥发,不能采用,氢氧化钠与氨气不反应,所以选③;氨气极易和硫酸反应被吸收,要防止倒吸.
【交流讨论】:(1)A中可能产生水蒸气,要防止它也作为氨气被吸收,但浓硫酸不但可吸收水蒸气,也吸收氨气,所以只能用碱石灰;
(2)要使结果准确,还要保证A中的氨气全部被B吸收,图中缺少赶尽反应装置中残留氨气的装置(或有氨气残留在装置中)
【计算过程】:
解:增重的3.4g为氨气的质最.
设13.5g样品中含有(NH
4)
2SO
4的质量为x.
(NH
4)
2SO
4+2NaOH

Na
2SO
4+2NH
3↑+2H
2O
132 34
x 3.4g
132:34=x:3.4g
解得:x=13.2g
(14×2)÷132×13.2g=2.8g
2.8g÷13.5g×100%=20.7%
20.5%≤20.7%≤21.0%,为合格品.
故答案为:【讨论交流】(1)过滤;漏斗;(2)CO
2;(3)CO
2+NH
3+H
2O=NH
4HCO
3【硫酸铵化肥等级测定】(1)盐酸(HCl)、硫酸(H
2SO
4)或硝酸(HNO
3)等;
实验设计:(2)③;防止倒吸;
交流讨论:(1)碱石灰;(2)缺少赶尽反应装置中残留氨气的装置(或有氨气残留在装置中)
计算过程:
解:增重的3.4g为氨气的质最.
设13.5g样品中含有(NH
4)
2SO
4的质量为x.
(NH
4)
2SO
4+2NaOH

Na
2SO
4+2NH
3↑+2H
2O
132 34
x3.4g
132:34=x:3.4g
解得:x=13.2g
(14×2)/132×13.2g=2.8g
2.8g÷13.5g×100%=20.7%,20.5%≤20.7%≤21.0%,为合格品.
分析:【讨论交流】(1)根据实验的目的确定操作方法,再根据操作方法来确定用到的仪器.
(2)先判断出过滤出来的物质,再分析发生的反应生成物,据图分析出结果.
(3)根据反应物,生成物,反应条件确定化学方程式.
【硫酸铵化肥等级测定】(1)根据碳酸盐的性质,确定碳酸氢氨是否存在.
【实验设计】:(2)从所给试剂的化学物理性质方面确定哪种效果最好;因氨气极易被吸收,要从防止倒吸的角度考虑干燥管的作用.
【交流讨论】:(1)A中可能产生水蒸气,要防止它也作为氨气被吸收;
(2)要使结果准确,还要保证A中的氨气全部被B吸收.
【计算过程】:B增重的质量为生成氨气的质量,根据它算出硫酸铵的质量,再进一步求出样品中硫酸铵的质量分数,判断是否合格.
点评:本题为综合型的大实验题,有实验又有计算,做题时要认真审题,要细心,步步为营.


 Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O

 Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
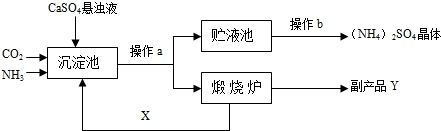
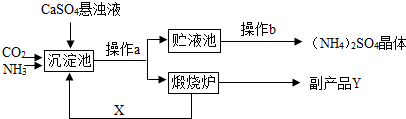

 某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程.
某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了制备(NH4)2SO4的工艺流程.