
【题目】实验探究和证据推理是提升认知的重要手段,化学兴趣小组对"CO2与NaOH溶液反应”的实验进行探究。
Ⅰ探究CO2的制备
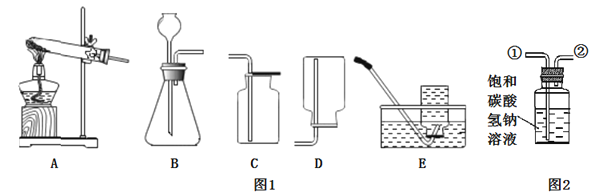
(1)实验室通常利用上图1中__(填字母)装置的组合制取并收集二氧化碳,反应的化学方程式为________
(2)图2所示装置可用于除去二氧化碳中少量的氯化氢气体,除杂时应将混合气体从导管____(填“①”或“②”)通入装置中。
Ⅱ探究CO2与NaOH溶液能否反应
实验甲:向两个装满二氧化碳的同样规格的瓶中分别注入等量的氢氧化钠溶液和蒸馏水,振荡后放在水平的桌面上(如图3)。
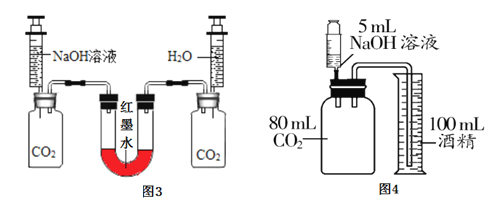
(1)若观察到U型左端液面_______(填“升高”成“降低”),则证明氢氧化钠能与二氧化碳反应。
(2)对静置后左瓶内的溶液进行下列操作,由对应的现象可推知CO2与NaOH一定反应的是_____(填对应选项的字母)。
a.滴加酚酞,溶液变为红色 b.滴加少量稀盐酸,不产生气泡 C,滴加少量氯化钙溶液,产生白色沉淀
实验乙:在NaOH固体中加入适量95%的乙醇溶液,配制成饱和NaOH的乙醇溶液,向该溶液中通入CO2,直至产生白色沉淀Na2CO3,证明氢氧化钠能与二氧化碳反应。
(3)该实验利用的原理是:___________影响物质的溶解性。
实验丙:如图4所示,将5mL溶质质量分数为10%的NaOH溶液(ρ≈1.1gmL)缓慢、全部注射入瓶中,观察到酒精倒流入瓶中,最终瓶中剩余5mL气体。此实验条件下,1体积水约可溶1体积CO2,CO2不溶于酒精。
(4)实验时_____________(填“能”或“不能”)用水代替量筒中的酒精。
(5)实验时将NaOH溶液缓慢注射入瓶中的原因是____________________。
(6)根据上述实验可推知:与NaOH反应的CO2约为________________(取整数)mL
【答案】 BC CaCO3 +2HCl==CaCl2 + H2O +CO2↑ ① 升高 C 溶剂 不能 防止CO2气体从导管逸出 70
【解析】本题主要考查了二氧化碳的制取,碱、盐的化学性质,物质的溶解性的影响因素等,综合性较强,仔细审题,弄清题意,灵活运用所学的知识。
Ⅰ探究CO2的制备
(1)实验室制取CO2,在常温下,用大理石或石灰石和稀盐酸制取,属于固—液常温型;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集,所以利用上图1中BC装置的组合制取并收集二氧化碳;碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,,反应的化学方程式为CaCO3 +2HCl==CaCl2 + H2O +CO2↑;
(2)图2所示装置可用于除去二氧化碳中少量的氯化氢气体,除杂时为了使混合气体与碳酸氢钠溶液充分接触,应将混合气体从导管①通入装置中;
Ⅱ探究CO2与NaOH溶液能否反应
(1)根据CO2与NaOH的反应,是气体被氢氧化钠溶液吸收,二氧化碳气体减少了,则U型管的左端的气压减小,从而导致U型管的左端液面升高;
(2)a、要证明CO2与NaOH溶液一定发生反应,只要证明反应后的溶液中含有Na2CO3即可。Na2CO3和NaOH溶液都呈碱性,因此无论CO2与氢氧化钠溶液是否反应,都会是无色酚酞试液变红,错误;b、如果NaOH溶液过量,滴加少量的稀盐酸会先与NaOH溶液反应,不会产生气泡,应滴加过量的稀盐酸,观察是否有气泡产生才能得到正确的结论,错误;c、氯化钙溶液不能与氢氧化钠溶液反应,氯化钙溶液能与碳酸钠溶液反应产生白色沉淀,如果有白色沉淀生成,说明一定含有碳酸钠,也就证明CO2与NaOH溶液一定发生了反应,正确。故选C;
(3) 将CO2通入氢氧化钠溶液生成的碳酸钠易溶于水,无明显变化,CO2通入氢氧化钠乙醇溶液生成的碳酸钠不能溶于乙醇,形成沉淀。实验乙利用的原理是溶剂影响物质的溶解性。
(4)二氧化碳能溶于水而不能溶液乙醇,实验时不能用水代替量筒中的酒精;
(5) 为了使二氧化碳能与氢氧化钠溶液充分反应,防止二氧化碳气体从导管逸出,实验时应将氢氧化钠溶液缓缓注入注射器中。实验时将NaOH溶液缓慢注射入瓶中的原因是防止CO2气体从导管逸出;
(6)加入氢氧化钠的溶液是5mL,1体积水约可溶1体积CO2,最终瓶中剩余5mL气体。可推知与NaOH反应的CO2≈80mL-5mL-5mL=70mL。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:初中化学 来源: 题型:
【题目】下图是实验室制取气体时常用的部分仪器,回答下列问题。
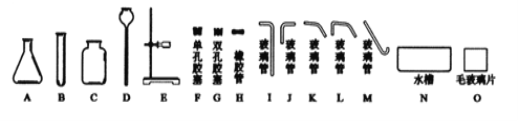
(1)实验室中制取二氧化碳,常用的药品为______;若用排水法收集,组装完整的装置需选用上图中的A、C、D、H、L、M、N、O和______;收集满气体后要用毛玻璃片______(选填“磨砂”或“光滑”)的一面盖住集气瓶口。
(2)在实验室里,利用![]() ↑反应制取氧气。获得0.8g氧气,理论上需要高锰酸钾____________g,若用右图所示装置,采用排空气法收集氧气,则气体应从_______(选“a”或“b”)管进入,验证氧气已经收集满瓶的方法是_______。
↑反应制取氧气。获得0.8g氧气,理论上需要高锰酸钾____________g,若用右图所示装置,采用排空气法收集氧气,则气体应从_______(选“a”或“b”)管进入,验证氧气已经收集满瓶的方法是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】通过对常见的酸和碱性质的学习,我们知道了酸能与某些金属单质发生反应,但并未提及碱溶液与单质的反应,实际上碱溶液也能与某些非金属单质反应,如氢氧化钠溶液能与氯气发生如下反应:
①![]()
②![]()
某化学兴趣小组的同学在实验室的实验台上发现上一组的同学做完氯气与氢氧化钠溶液的反应后残液未倒掉,遂对该残液的成分进行猜想和实验验证。请你与他们一起完成探究过程。
【猜想】除水外(1)可能含 NaClO和NaCl
(2)可能含 NaClO、NaCl和NaOH
(3)可能含NaClO3、NaCl
你认为还可能是______________________.
【查阅资料】
(1)次氯酸钠(NaClO)溶液呈碱性;有强氧化性,可使淀粉碘化钾试纸变蓝;不稳定,在光照或加热条件下均能分解:2NaClO![]() 2NaCl+O2↑;3 NaClO
2NaCl+O2↑;3 NaClO![]() NaClO3+2NaCl
NaClO3+2NaCl
(2)氯酸钠溶液呈中性。
【实验验证】
实验步骤 | 现象 | 结论 |
(1)取残液滴在淀粉碘化钾试纸上 | 试纸变蓝 | _______________ |
(2)取残液于试管中,加热一段时间,冷却后___________ | 试纸不再变蓝 | ________________ |
(3)________________ | _____________ | 猜想2正确 |
【反思交流】对反应后溶液中溶质的确定,除考虑生成物外还应考虑_____________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】食用油脂能供给人体必需脂肪酸,促进脂溶性维生素的吸收,是最常用的食品和调味品。食用油脂是一种高热量食品,每克油脂在体内氧化释放37.7kJ的热量,比等质量的糖和蛋白质高一倍多,再加上不同油脂成分的差异性,使如何选择和使用食用油脂存在不少盲区和误区。
食用油脂中99%以上是脂肪酸,还含有维生素A、E,少量矿物元素钙、钾等。食用油中脂肪酸种类繁多,主要分类方法见表1。不同油脂中,各种脂肪酸的含量不同,常见食用油中脂肪酸组成(%)如表2。
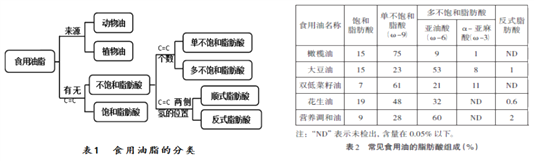

脂肪酸不仅种类繁多,功能也各异。饱和脂肪酸能平衡血浆中脂肪酸浓度,摄入过高会导致胆固醇、甘油三酯等升高,继而引发动脉管腔狭窄;单不饱和脂肪酸分子内的碳原子之间存在一个碳碳双键(C=C),主要是油酸(C18H34O2,ω-9),油酸能降低总胆固醇和有害胆固醇,但不会降低有益胆固醇;多不饱和脂肪酸主要有亚油酸(C18H32O2,ω-6)和α-亚麻酸(C18H30O2,ω-3),它们是人体必需脂肪酸,而且人体不能合成,必需从食物中摄入。亚油酸有“血管清道夫”的美誉,能防止血清胆固醇在血管壁沉积;α-亚麻酸在人体分解后形成生命活性因子DHA和EPA,是大脑的重要营养要素,DHA能提高记忆力和思维能力,EPA能降低血液中胆固醇和甘油三酯的含量,降低血液粘稠度。
天然状态下,不饱和脂肪酸多数为顺式脂肪酸。反式脂肪酸主要存在于奶油类、煎炸类和烘烤类食品中,受加热过程影响,油品中反式脂肪酸含量(质量分数/%)发生变化。其变化过程如右图所示。反式脂肪酸可妨碍必需脂肪酸在人体内的代谢,提高总胆固醇与高密度脂蛋白的比例,从而增加冠心病发病风险。
依据文中内容,回答下列问题:
(1)食用油脂能为人体提供的营养素有__________。
(2)按油脂分类,花生油属于___________。
(3)常见食用油中多不饱和脂肪酸含量最高的是__________。
(4)关于食用油脂,下列说法正确的是__________。
A.应少吃油炸、烘焙类食品
B.食物营养素中,热量最高的是脂肪
C.烹调食物时,最好将油温控制在260oC以下
D.油酸和亚油酸分子中碳碳双键的个数不同
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C三种物质的溶解度曲线如图所示。下列分析正确的是
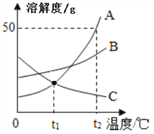
A. 三种物质的溶解度:A>B>C
B. t2℃时,把50gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1:2
C. 将t2℃时,A、B两种物质的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数的大小关系是B>A
D. 将C的饱和溶液变为不饱和溶液,可采用升温的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是某反应的微观示意图,已知:2个甲分子反应生成1个丙分子和3个乙分子,则下列关于该反应的判断正确的是
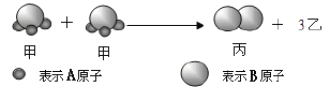
A. 该反应不遵守质量守恒定律
B. 反应前后无元素化合价改变
C. 该化学反应中分子的数目、种类均发生改变
D. 乙物质属于化合物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组想检测黄铜(铜、锌合金)中铜的质量分数,组员们取10g黄铜样品,向其中分三次共加入30g稀硫酸溶液,充分反应后测得实验结果如下:
实验次数 | 1 | 2 | 3 |
硫酸质量 | 10g | 10g | 10g |
氢气质量 | 0.04g | m | 0.02g |
试计算:
(1)第二次实验产生氢气的质量m为___________g。
(2)黄铜(铜、锌合金)中金属铜的质量分数__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验是化学的根本,请根据图示回答问题:
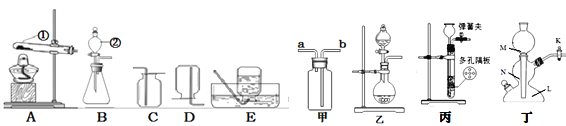
(1)写出仪器名称:①______;②______。
(2)装置A-E中,实验室用高锰酸钾制取氧气时,发生装置可选______;收集装置可选______;反应的化学方程式为______。
(3)选装置甲收集CO2时气体应从______进,验满的方法是______;可用装置BD组合制备收集的常见气体是______。
(4)加热二氧化锰和浓盐酸的混合物能得到氯气,小明选择乙作为发生装置,还需要补充的仪器是______、______和铁圈。
(5)装置乙、丙均可用于制备CO2,反应方程式为______;丙与乙相比优点是______;装置丁为启普发生器,作用与丙相同,打开K生成气体便可以逸出,大理石应放在______(填“M”、“N”或“L”)处。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以饱和NaCl溶液、饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+ NH4HCO3=NaHCO3↓+NH4HCl(已知: NH4HCO3在40℃时受热易分解)回答下列问题。
(1)该反应中的四种物质溶解度曲线如图所示。
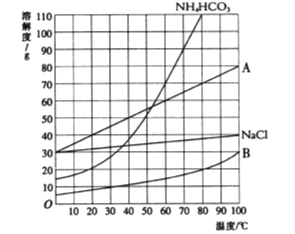
①35℃时,比较A、B溶解度的大小:A_________(填“<”或“>”)B。
②图中表示NaHCO3溶解度曲线的是_________(填“A”或“B”)。
(2)为探究NaHCO3析出的最佳条件,某化学兴趣小组完成了下表中的几组实验:
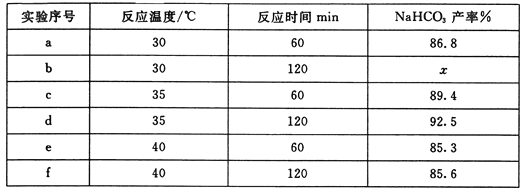
①实验c和d的目的是____________________。
②表格中 的数值可能为_______(填字母)。
A. 85.8 B. 86.8 C. 92.1 D. 93.1
③在相同反应时间内,40℃时NaHCO3的产率比35℃时低的原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com