
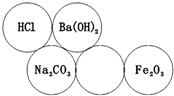
 “五环”也能应用在化学中.如图所示,每个环代表一种物质(环内物质不能重复),两环相切表示两种物质可以发生化学反应.回答下列问题:
“五环”也能应用在化学中.如图所示,每个环代表一种物质(环内物质不能重复),两环相切表示两种物质可以发生化学反应.回答下列问题:分析 根据稀硫酸能和氢氧化钡反应生成硫酸钡沉淀和水,能和碳酸钠反应生成硫酸钠、水和二氧化碳,能和氧化铁反应生成硫酸铁和水分析;碳酸钠和氢氧化钡反应能生成碳酸钡沉淀和氢氧化钠.据此分析判断回答有关的问题.
解答 解:①根据稀硫酸能和氢氧化钡、碳酸钠、氧化铁等物质发生化学反应,空环中物质可以是稀硫酸,硫酸的化学式是H2SO4;故填:H2SO4.
②氢氧化钡属于碱,硫酸属于酸,氢氧化钡和硫酸反应生成硫酸钡白色沉淀和水,属于中和反应,反应的化学方程式为:Ba(OH)2+H2SO4═BaSO4↓+2H2O,故填:Ba(OH)2+H2SO4═BaSO4↓+2H2O.
③碳酸钠属于盐,氢氧化钡属于碱,碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,反应的化学方程式为:Na2CO3+Ba(OH)2═BaCO3↓+2NaOH,故填:Na2CO3+Ba(OH)2═BaCO3↓+2NaOH.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质题中的转换关系推导剩余的物质,最后进行验证即可.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 人的胃酸过多,会引起胃病.如图所示是某抗酸药标签上的部分文字.某同学为了测定该药中氢氧化铝的质量分数,进行如下操作:取一片药片(药片质量0.5g),研碎后加20mL蒸馏水,然后用质量分数为5%的盐酸至反应完全(其他成分不与盐酸反应),测定实验中反应掉的盐酸为6.0g.通过计算,判断该药片中氢氧化铝的含量是否达到标准以及该药片中氢氧化铝的质量分数.
人的胃酸过多,会引起胃病.如图所示是某抗酸药标签上的部分文字.某同学为了测定该药中氢氧化铝的质量分数,进行如下操作:取一片药片(药片质量0.5g),研碎后加20mL蒸馏水,然后用质量分数为5%的盐酸至反应完全(其他成分不与盐酸反应),测定实验中反应掉的盐酸为6.0g.通过计算,判断该药片中氢氧化铝的含量是否达到标准以及该药片中氢氧化铝的质量分数.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com