
【题目】如图是甲、乙、丙三种物质的溶解度曲线。
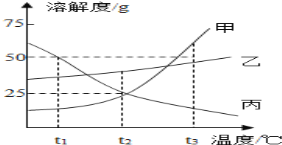
(1) 甲的溶解度为25g时的温度为_________。
(2) t3℃时,甲、乙各50g,分别加入到100g水中,充分搅拌。其中,不能形成饱和溶液的是_____。
(3) t3℃时,甲的饱和溶液中含有少量的丙,现要提纯甲可采用的结晶方式是____________
(4) 下列说法正确的是_________
A. 将甲、乙的饱和溶液分别从t1℃升温到t2℃,溶质的质量分数都不变
B. t2℃时,向100g甲的饱和溶液中加100g水,充分搅拌,溶液的浓度为10%
C. t3℃时,等质量的甲、乙、丙分别制成饱和溶液,需水的质量最多的是甲
D. 升高丙的饱和溶液的温度,一定有晶体析出
【答案】 t2![]() ; 甲,; 降温结晶; ABD
; 甲,; 降温结晶; ABD
【解析】(1) 在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。甲的溶解度为25g时的温度为t2![]() ;(2) 溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。 t3℃时,甲的溶解度大于50g,乙的溶解度小于50g,甲、乙各50g,分别加入到100g水中,充分搅拌。甲不能形成饱和溶液;(3)甲的溶解度随温度的降低迅速减小,而丙的溶解度随温度降低而增大, t3℃时,甲的饱和溶液中含有少量的丙,现要提纯甲可采用的结晶方式是降温结晶;(4) A. 甲、乙的溶解度都随温度升高而增大,将甲、乙的饱和溶液分别从t1℃升温到t2℃,溶质不析出,溶质、溶剂的质量都不改变,溶质的质量分数都不变,正确;B. t2℃时,甲的溶解度为25g,即125g饱和溶液中有25溶质,则100g甲的饱和溶液中有20g溶质,向100g甲的饱和溶液中加100g水,充分搅拌,溶质为20g,溶液为200g,溶液的浓度为10%,正确;C. t3℃时,三种物质的溶解度由大到小为:甲>乙>丙,等质量的甲、乙、丙分别制成饱和溶液,需水的质量最少的是甲,需要水最多的是丙,错误;D. 丙的溶解度随温度升高而减小,升高丙的饱和溶液的温度,一定有晶体析出,正确。故选ABD。
;(2) 溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。 t3℃时,甲的溶解度大于50g,乙的溶解度小于50g,甲、乙各50g,分别加入到100g水中,充分搅拌。甲不能形成饱和溶液;(3)甲的溶解度随温度的降低迅速减小,而丙的溶解度随温度降低而增大, t3℃时,甲的饱和溶液中含有少量的丙,现要提纯甲可采用的结晶方式是降温结晶;(4) A. 甲、乙的溶解度都随温度升高而增大,将甲、乙的饱和溶液分别从t1℃升温到t2℃,溶质不析出,溶质、溶剂的质量都不改变,溶质的质量分数都不变,正确;B. t2℃时,甲的溶解度为25g,即125g饱和溶液中有25溶质,则100g甲的饱和溶液中有20g溶质,向100g甲的饱和溶液中加100g水,充分搅拌,溶质为20g,溶液为200g,溶液的浓度为10%,正确;C. t3℃时,三种物质的溶解度由大到小为:甲>乙>丙,等质量的甲、乙、丙分别制成饱和溶液,需水的质量最少的是甲,需要水最多的是丙,错误;D. 丙的溶解度随温度升高而减小,升高丙的饱和溶液的温度,一定有晶体析出,正确。故选ABD。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】如图为甲乙两种固体在水中的溶解度曲线,下列说法正确的是( )
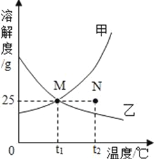
A. t2℃时,将甲乙两种物质的饱和溶液降低至t1℃,仍为饱和溶液
B. t1℃时,甲乙饱和溶液的溶质质量分数为20%
C. 甲物质中混有少量乙,可采用蒸发溶剂方法提纯甲
D. t2℃时,N点表示乙物质的不饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是
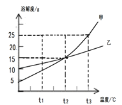
A. 乙中含有少量甲,可用冷却热饱和溶液的方法提纯甲
B. t3℃时,甲的溶液溶质质量分数一定大于乙的溶液溶质质量分数
C. t3℃时,将等质量的甲、乙两种物质的饱和溶液分别降温至t2℃,析出晶体的质量甲一定大于乙
D. t1℃时,乙的不饱和溶液只有通过蒸发溶剂的方法才能转变成饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是自然界中碳、氧循环简图(X为H2CO3,Y为C6H12O6)。下列说法不正确的是

A. 图一中的转化1是酸雨形成的主要原因
B. 图二中可实现有机物与无机物的相互转化
C. 绿色植物通过光合作用,将太阳能转化成化学能
D. 碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外研究小组,用废弃的黄铜(铜锌合金),通过两种途径制取硫酸铜晶体。实验流程如图所示:
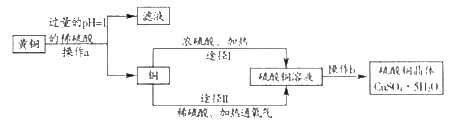
(1)操作a为_____,该操作中用到的玻璃仪器有烧杯、_____、玻璃棒。
(2)浓硫酸是化学实验室里一种常见的酸。
①实验室稀释浓硫酸的操作是:将_____,并用玻璃棒不断搅拌。
②化学实验应高度关注安全问题。若不慎将少量浓硫酸沾到皮肤上,应先用大量水冲洗,再涂_____溶液。
(3)如图是实验室用过氧化氢溶液和二氧化锰制取氧气的装置。
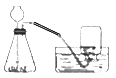
①主要实验操作步骤有:
a.收集气体 b.检查装置气密性 c.将二氧化锰放入锥形瓶中 d.从长颈漏斗中注入过氧化氢溶液
正确的操作顺序是_____(写字母序号)。
②在实验过程中,某同学因加入的药品量不足,致使集气瓶内剩余少量水。若想集满这瓶氧气,在不拆卸装置和不添加药品的前提下,请帮他想出种解决的方法_____。
(4)操作b的顺序为蒸发浓缩、_____ 过滤、干燥。
(5)下列测定稀硫酸pH的操作正确的是_____ (写字母序号)。
A.将pH试纸直接插入稀硫酸中
B.先将pH试纸用蒸馏水润湿
C.用玻璃棒蘸取少量稀硫酸,滴在pH试纸上
D.根据试纸显示的颜色估算出溶液的pH
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图,回答下列问题:
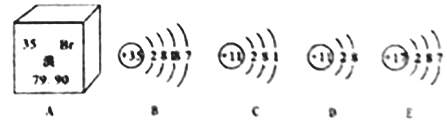
(1)图A所示中溴的相对原子质量是__________________;
(2)与B的化学性质相似的粒子是___(填字母序号);
(3)D的粒子符号为____________________;
(4)B与C形成化合物的化学式为_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】汽车尾气催化转换器可减少有害气体的排放,其中某一反应过程的微观变化如图所示。请回答下列问题:
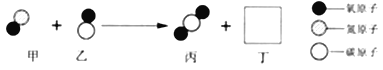
(1)化学反应前后:物质总质量是否发生改变? _____ (选镇“是”或“否”);种类发生改变的微粒是_____ ( 选填“分子”或“原子”)。
(2)丙微粒中碳元素的化合价为___________。
(3)已知丁是一种单质,则丁是_________ ( 写化学式)。
(4)该反应的化学方程式为____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某实验小组利用废硫酸液制备K2SO4并研究CaSO42H2O加热分解的产物。
(一)K2SO4的制备
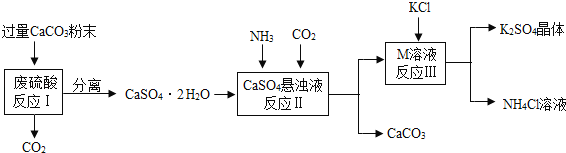
(1)将CaCO3研成粉末的目的是___________________________________。
(2)M物质的化学式为__________。
(3)反应Ⅲ中相关物质的溶解度如下表。
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下能实现的原因是_______________________________________。
(4)上述流程中可循环使用的物质有CO2和_____________(填写化学式)。
(二)研究CaSO42H2O加热分解的产物
(5)分离出的CaSO42H2O中常含有CaCO3,可用盐酸除去CaCO3,
该反应的化学方程式_______________________________________________。
(6)为了测定CaSO42H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验。注:碱石灰的主要成分为NaOH和CaO。
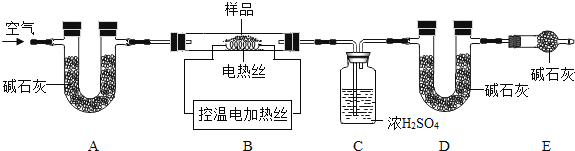
① 实验前首先要________________,再装入样品。装置A的作用是_________________。
② 已知:CaSO42H2O在160℃生成CaSO4,1350℃时CaSO4开始分解; CaCO3在900℃时分解完全。
现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将______。(填“偏大”、“偏小”或“无影响”)你认为还可选用上述的________________(选填序号)两个数据组合也可求出x:y的值。
(7)CaSO42H2O受热会逐步失去结晶水。取纯净CaSO42H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示。
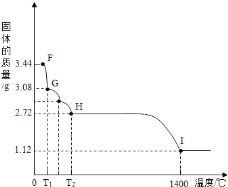
则G点固体的化学式是_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用适当的化学方程式说明或解释下列问题:
(1)用石灰浆粉刷墙面,干燥后变得坚硬_______________________________
(2)服用Al(OH)3的药丸治疗胃酸过多症_________________________
(3)生活中铝锅表面易形成有较强的抗腐蚀性的氧化膜 _____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com