
����Ŀ�������仯����������������Ӧ�÷dz��㷺��
��һ�������ϵ��й�֪ʶ

��1������ʹ�ý����Ⱥ���������ͭ������������ʱ����ֱ�������ſ�ʼ����ʹ�������ϡ���Ҳ��ӳ��Cu��Fe�� Al���ֽ����Ļ����ǿ������˳����_______________��
��2��������������˾�ϣ���ͼ���IJ��ϣ�������������������������Ҫ��________________��
��3���ҹ�C919���Ϳͻ�ȥ�꾪�����࣬�ͻ��ϴ��ģʹ��̼��ά���ϲ��ϡ���﮺Ͻ����ѺϽ������մɵ��Ƚ����ϣ����в��漰���IJ�����_________��ѡ����ţ���
A �Ͻ�
B ���ǽ�������
C �ϳɲ���
D ���ϲ���
��4������ʯ�г�������������FeS2���ȡ���ҵ���û�������ȡ���������������������������ԭ����:��ұ���в���SO2��Ⱦ��������______________��
��������ȡ��ʽ������
��ʽ��������-�ַ�ˮ�������������᳧�ķ�������Ҫ�ɷ�Ϊ�������������FeS��SiO2���Ʊ���ʽ����������[Fe4��OH��2��SO4��5��6H2O]��Ҫ��������:

��1������Ӧ��ĥ�ɷ�ĩ��Ŀ����_____��
��2��������������������H2S����Ļ�ѧ����ʽΪ________
��3�����˺�ϴ�ӣ�֤��������ϴ���ķ�����_______��
��4����ת����������Ӧ�Ļ�ѧ����ʽΪ_______���÷�Ӧ�¶Ȳ��˹��ߵ�ԭ����________��
��������ʽ������������ȷֽ�ʵ��
��ȤС���ȡ�˾�����Ʒ25.38g���ڿ�����Ա��ָ��������ͼװ�ý����ȷֽ�ʵ�顣
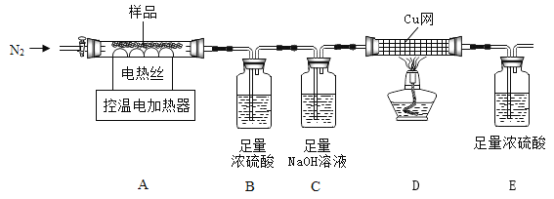
[��������]�ټ�ʽ���������壨��Է�������Ϊ846��200��C��ȫ�ֽ�����Fe2O3��H2O��Fe2��SO4��3��
��Fe2��SO4��3��500��C��ȫ�ֽ�ΪFe2O3��SO2��SO3��O2��
��Bװ����Ũ����ֻ������SO3��H2O��.
��1��װ���ʵ��װ�ú���Ҫ_________��
��2������ǰ�����о�ͨ��N2,ֹͣ���Ⱥ����ͨN2��Ŀ���Ƿ�ֹ������______��
��3�����Ʋ�ͬ���¶ȶ�A�й�����ȣ����װ��B��C��D�е������仯���±������ʣ������������¶ȵı仯��ͼ��ʾ��

�¶�/C | ���� | 220 | 520 |
Bװ��/g | 200.00 | 203.78 | 207.78 |
Cװ��/g | 200.00 | 200.00 | x |
Dװ��/g | 100.00 | 100.00 | 101.60 |
����ͼ��m1=____________��
�ڱ�����x=_____________��
�۽����յ�ʣ�����������ȵ����ߵ��¶ȣ����ֹ������0.32g���������ٸı䣬д���˹����з�����Ӧ�Ļ�ѧ����ʽ____________��
���𰸡�Al��Fe��Cu Fe3O4 C ��������Ե� ����Ӧ���ĽӴ�������ӿ췴Ӧ�������Ĵ𰸾����֣� ![]() ȡ���һ��ϴ�Ӻ����Һ������BaCl2 ���������Ĵ𰸾����֣�
ȡ���һ��ϴ�Ӻ����Һ������BaCl2 ���������Ĵ𰸾����֣� ![]() ��ֹH2O2�ֽ� ���װ�õ������� ʹ���ɵ�������ȫ������Ӧװ�����գ�����ʵ����� 21.60 206.40
��ֹH2O2�ֽ� ���װ�õ������� ʹ���ɵ�������ȫ������Ӧװ�����գ�����ʵ����� 21.60 206.40 
��������
��һ����1������ʹ�ý����Ⱥ����ˡ���ͭ������������ʱ����ֱ�������ſ�ʼ����ʹ�������ϣ����ڽ���Խ���ã�������ʶ�����õ�Խ��������Cu��Fe�� Al���ֽ����Ļ����ǿ������˳���ǣ�Al>Fe>Cu��
��2��������������˾�ϣ���ͼ���IJ��ϣ�������������������������Ҫ�ǣ�Fe3O4��
��3��̼��ά���ϲ������ڸ��ϲ��ϣ���﮺Ͻ����ڽ������ϣ����ѺϽ����ڽ������ϣ������մ��������ǽ������ϣ��ʲ��漰���IJ����Ǻϳɲ��ϡ���ѡC��
��4������������Ԫ�ص���������Ϊ��![]() ��
��
����������Ԫ�ص���������Ϊ��![]() ��
��
����������Ԫ�ص���������Ϊ��![]()
�ʻ������к�������Խϵͣ���˲�����������
��������ȡ��ʽ������
��1������Ӧ��ĥ�ɷ�ĩ��Ŀ��������Ӧ���ĽӴ��������߷�Ӧ���ʣ�
��2�������ܡ�������FeS��ϡ���ᷴӦ����H2S���壬�÷�Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
��3����Ϊ��Һ�к���������ӣ��ʹ��˺�ϴ�ӣ�֤��������ϴ���ķ����ǣ�ȡ���һ��ϴ�Ӻ����Һ������BaCl2 ������
��4����ת����Ϊ����������������⡢ϡ���ᷴӦ������������ˮ��������Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
�������������ֽ⣬�ʸ÷�Ӧ�¶Ȳ��˹��ߵ�ԭ���Ƿ�ֹH2O2�ֽ⣻
��������ʽ������������ȷֽ�ʵ��
��1��װ���ʵ��װ�ú���Ҫ���װ�õ������ԣ�
��2������ǰ��ͨ�뵪����Ϊ�˽�װ���ڵĿ����ž�����ֹ����Ӱ��ʵ������ʵ�������ͨ�뵪����Ϊ�˽���Ӧ���ɵ�����ȫ���ų�������Ӧ��װ�����գ�ֹͣ���Ⱥ����ͨN2��Ŀ���Ƿ�ֹ����������ʹ���ɵ�������ȫ������Ӧװ�����գ�����ʵ����
��3���ټ�ʽ���������壨��Է�������Ϊ846��200����ȫ�ֽ�����Fe2O3��H2O��Fe2(SO4)3����m1��Ϊ��ʽ��������������ȥ����ˮ�������������µ�220��ʱ��Bװ�����ӵ�������Ϊ����ˮ��������������ˮ������Ϊ��203.78-200=3.78��m1=25.38g-3.78g=21.60g��
��Fe2(SO4)3��500��C��ȫ�ֽ�ΪFe2O3��SO2��SO3��O2��Dװ�����ӵ�������Ϊ������������������������������Ϊ��101.6g-100g=1.6g��Cװ�����ӵ�����Ϊ���ɶ��������������
��Fe2(SO4)3��500��C��ȫ�ֽ�ΪSO2������Ϊx

![]() ��
��![]()
x=6.4g��y=8.0g
������x=200.00g+6.4g=206.40g��
�����ʣ�����ΪFe2O3����ʽ�����������������ȥ���ɵ�ˮ��������������������������������Fe2O3������������Ϊ��25.38g-6.4g-7.78g-1.6g=9.6g
Fe2O3����Ԫ�ص�����Ϊ��![]() ��
��
Fe2O3����Ԫ�ص�����Ϊ��9.6g-6.72g=2.88g��
�����յ�ʣ�����������ȵ����ߵ��¶ȣ����ֹ������0.32g��������Ϊ������������������ʣ����Ԫ�ص�����Ϊ��2.88g-0.32g=2.56g��
��ʣ�����������ɵ�����������Ļ�ѧʽΪ��FexOy��5x��16y=6.72g��2.56g��x��y=3��4�������ɵ�����������ΪFe3O4���ʷ�����Ӧ�Ļ�ѧ����ʽΪ�� ��
��


 �����������Ů��ͯ������ϵ�д�
�����������Ů��ͯ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ����Һ��������������������Ҫ�����á�
��1�������г���___________�ķ�������ˮ��Ӳ�ȡ�
��2������������ˮ�в����γ���Һ����_____________������ţ���
A ���� B ���� C ʳ��
��3�����ˮʱ�������ϲ�����������е�������__________������ţ���
A ����֧��ȼ�� B ������ˮ C ��ȼ��
��4����������Һʱ��ͨ��������Ҫˮ�����Ϊ 20mL����ȡʱ���Ӷ������ᵼ��������Һ��������������__________����ƫ��ƫС����Ӱ�죩��
��5������ˮ��������������ԭ����������ˮ��Ӧ���ɴ����ᣨHClO�����������䷴Ӧ���۹��̿�����ͼ��ʾ��
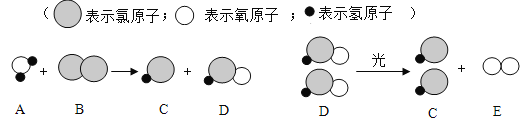
��д��������ˮ��Ӧ�Ļ�ѧ����ʽ____________ ��
��D ����Ԫ�صĻ��ϼ�Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ������֮Դ��Ҳ�ǹ�ũҵ��������ȱ�ٵ����ʡ��������úͱ���ˮ��Դ�������岻�ݴǵ����Ρ�
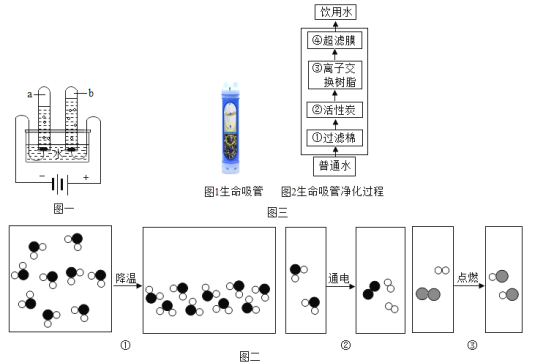
��1����ͼһ��ˮͨ��ֽ��ʾ��ͼ��
����ʵ������У��Թ�a�в�����������_____��д���÷�Ӧ�Ļ�ѧ����ʽ��_____��
�ڼ���b�Թ�������IJ���������������_____��
��2����ͼ���ֱ���ˮ����Һ����ˮͨ��ֽ��������������ȼ�յ��۱仯ʾ��ͼ����ش��������⣺
��ͼ�۱�ʾ�Ļ�ѧ����ʽΪ_____��
�ڴ��۽ǶȽ���ͼ�١�ͼ�ڵı���������_____��
����ͼ�ڡ�ͼ�ۿɵõ�����ѧ�仯��һ�������������_____�����ܷ����ı���Ƿ��ӵ�_____��
��3����������������ֱ�ӽ���ˮ����Ϊ����ˮ����Ҫ��������������ˮ�ľ����������ƣ���ͼ����ʾ�������ӽ�����֬����Ҫ������ȥ���ؽ������ӡ�����ˮ�ʣ�
���������������л���̿��������_____������ĸ����ͬ��������Ĥ��������_____
A��ȥ���к����Ͳ��ֲ��� B���������� C����ȥ�ϴ�IJ���������
�������������ܣ�ȡ�ú�ˮʱ��Ҫ����ˮ��Ӳ�Ⱥ�ɱ��ԭ��������г���ȡ_____������
��������������������_____������ţ���
A���ϸ��ܻ��ʺ�ũҩ��ʹ��
B������̽����ˮ�������¼���
C������ϵط�ˮϴ�·�
D������ˮ�����ж���ֲ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����۱�ʶ����̽���ǻ�ѧѧϰ�Ķ���˼ά��
(1)��ͼ����������������Һ(�ѵμ�������̪��Һ)�������μ�ϡ�����̽��ʵ�顣��ش�:

�ٴӺ�۽Ƕȿ��Կ�����ϡ����μӵ�10mLʱ����Һ����ɫ�仯Ϊ______________����ʱ��Һ���¶���________________��
�ڵ���Һ���¶Ƚ�Ϊ38��Cʱ����֤����Һ�����������Ƶ�ʵ�鷽����________________(�����)��
AƷ���ձ�����Һ��ζ��
B����մȡ�ձ��е���Һ�������Ƿ�����ā��
C���ձ����ٵμ���������������Һ���۲�˲����Һ��ɫ
D�μ�̼������Һ���۲�����������
����ͼA��ʾ����NaHSO4��Һ�еμ�NaOH��Һ���ɷ�Ӧ��ʵ�ʿ����ƶϣ�����NaHSO4ˮ��Һ�м������Zn���ܷ��������______ (�� ����������������)��

(2)�Ȼ�������Ҫ�ĵ�ζƷ������������ȱ�ٵ�ζ������ͼ�ֱ��ʾ��ͬ�Ļ�ѧ��Ӧ�������漰���Ȼ��ơ�

�ٽ�������������ȼ�ղ����������̣�ͼ1�Ƕ��߷�Ӧ�����Ȼ��Ƶ���ʾ��ͼ����ͼ1��֪��Ԫ�صĻ�ѧ������Ҫ��ԭ�ӵ�______________(����ĸ���)�����еĹ�ϵ��
A����������
B�˵����
C���Ӳ���
D���ԭ������
��ͼ2�������Ȼ�������������Һ�ķ�Ӧ������A��B��C�������������ű�ʾ�÷�Ӧ��ʵ��____________��
��ͼ3��ʾ�������������������������________ (д��ѧʽ)���÷�Ӧ�Ļ�ѧ����ʽΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ձ���ʢ��CuSO4��H2SO4�Ļ����Һ100.0g,�������Ⱥ�μ�BaCl2��NaOH��Һ���ձ�����Һ��������μ���Һ��������ϵ��ͼ��ʾ��

����˵����ȷ����
A.ab �β�������ѧ��Ӧ
B.c����Һ��ֻ��2������
C.��BaCl2��Һ��������������Ϊ41.6%
D.�û����Һ��CuSO4��H2SO4��������Ϊ80:49
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܶ����ֲ���ʯ������ɵ�ɽ���У�ʯ���ҵ���Ҫ�ɷ���̼��ƣ����������ж�����̼��ˮʱ���ᷴӦ�����ܽ��Խϴ��̼����ƣ�CaCO3+CO2+H2O=Ca(HCO3)2��ij��ѧ��ȤС��ͬѧ��˼��������̼������Һ��ͨ��һ����������̼���Ƿ�������̼�����ƣ�NaHCO3�����������ǿ�ʼʵ��̽�����������Ƕ�����̼��̼����Ϊ���ʵ������
��������⣩
������Һ���������ʳɷ���ʲô��
���������ϣ�
��1��̼�����Σ���Ca(HCO3)2��Ba(HCO3)2��NaHCO3�ݶ�������ˮ
��2��Na2CO3��NaHCO3����Һ�ʼ��ԡ�BaCl2��Һ������
��������룩
����һ������ΪNa2CO3�������������Ϊ NaHCO3��������������Ϊ_____��
��ʵ����֤��
ʵ�鲽�� | ʵ������ | ʵ����� |
��1��ȡ��Ӧ����Һ�������Թ��У��μӼ���_____��Һ�� | ��Һ���ɫ | ����Һ�Լ��� |
��2��ȡ��Ӧ����Һ�������Թ��У������еμӹ�����BaCl2��Һ�� | �а�ɫ�������� | ����_____������ |
��3��_____ | _____ | ���������� |
���ó����ۣ�������������֤��������̼ͨ��̼������Һ������̼�����ơ�
����չӦ�ã�ͬѧ�ǻ���ʵ�����ó���ʯ��ˮ���������̼���龰���������֪ʶ�������һ�����ij���ʯ��ˮ�в���ͨ�������̼���壬������һ��ͼ������ȷ��ӳ���ɵ�̼��Ƴ����������̼������֮��ı仯��ϵ_____������ĸ��ţ���
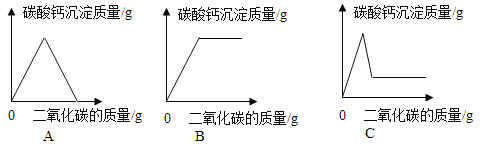
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���ģ�ʡ�Լг��������ش����⣺
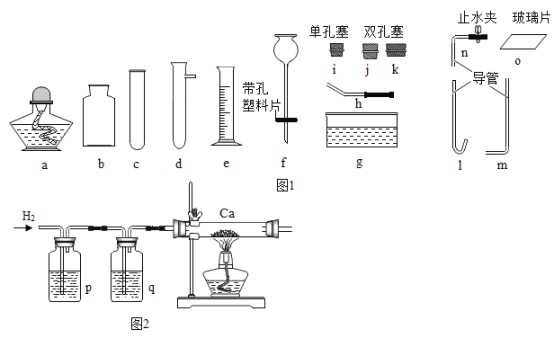
��1������e��������_____��
��2�����ȷֽⰵ��ɫ��ĩ��ȡO2�Ļ�ѧ����ʽΪ_____����ȡ���ռ�һƿO2��������˿ȼ��ʵ�飬Ӧѡȡ��������c��h��i��_____������ţ�����˿��O2��ȼ������_____��
��3����п����ϡ�����Ʊ�H2��Ϊ���ڿ��Ʒ�Ӧ��������ֹ������װ��Ӧѡȡ����c��j��_____��ϣ�����ţ���
��4���⻯�ƣ�CaH2�� ����������ˮ��Ӧ����һ�ּ��H2�����ȿ�������Яʽ��Դ��С�����ã�3���в�����H2������Ʒ�Ӧ��ȡCaH2 ����ͼ2������ش�
��ϴ��ƿ��pΪNaOH��Һ����qӦѡ�����Լ���_____������ţ���
A NaHCO3��Һ
B KOH��Һ
C ŨH2SO4
��Ϊ��ֹCa���������ڼ���Ca֮ǰ������еIJ�����_____��
��CaH2��ˮ��Ӧ�Ļ�ѧ����ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ⱦ��ʱ���õ�����ɫ�������Ա���������ѧʽΪC6H8N2����һ���ж���ѧҩƷ�����°��ԣ�����˵����ȷ���� �� ��
A. �Ա������к���N2����
B. �Ա�������̼���⡢��Ԫ�ص�������Ϊ6:8:2
C. �Ա�������6��̼ԭ�ӡ�8����ԭ�Ӻ�2����ԭ�����
D. �Ա�������̼Ԫ�ص�������������ʽΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ѡ��4��װ������ȡ�ϴ�����CO2���塣
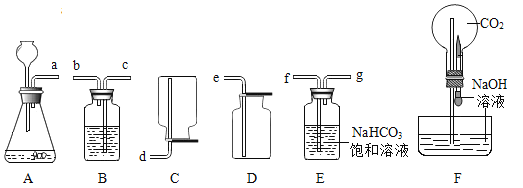
��1����ȷ�Ľӿ�˳�����������Ϊ�� a��_____��B��ʢ�ŵ�Һ����_____��
��2��ָ����ѡװ����һ�����ԵĴ�����_____��
��3����ͼ�е�Fװ�ÿ�������ʮ����Ȥ�ġ���ѧ��Ȫ��������ͷ�ι��е�NaOH��Һ����Բ����ƿʱ���ܿ쿴�������ܶ��˲�������Ȫ������������Ȫ�������ԭ����_____��������ƿ�ڵ�CO2�����������������е�_____������ĸ��ţ��Կɲ�������Ȫ������
A SO2
B H2
C CO
D HCl
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com