
| 试验次数 | 1 | 2 | 3 | 4 | 5 |
| 加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 充分反应后剩余固体的质量/g | 8 | 6 | 4 | 3 | m |
| 所得溶液的硫酸铜质量分数/% | P1 | P2 | P3 | P4 | P5 |
分析 (1)根据实验数据分析出加入的稀硫酸与参加反应的氧化铜的质量比关系,进而可确定m的值;固体前后减少的质量为氧化铜的质量;
(2)根据实验数据可知20克稀硫酸与2克氧化铜恰好完全反应,利用氧化铜与硫酸反应的化学方程式,根据2克氧化铜的质量求出20克稀硫酸中溶质的质量,进一步求出稀硫酸中溶质的质量分数;
(3)根据所得溶液中溶质的质量分数公式判断.
解答 解:(1)根据实验数据分析可知,第一次加入20克稀硫酸,有(10-8)gCuO被消耗掉,因此每20克稀硫酸与2克氧化铜恰好完全反应,第四次加入20克稀硫酸后只减小了1克氧化铜,说明氧化铜已反应完,第五次再加入稀硫酸,剩余固体的质量也不会减少.所以m的值为3.
氧化铜的质量=10g-3g=7g;
(2)设20克稀硫酸中溶质的质量为x
CuO+H2SO4═CuSO4+H2O
80 98
2g x
$\frac{80}{2g}$=$\frac{98}{x}$
x=2.45g
H2SO4溶液中溶质质量分数=$\frac{2.45g}{20g}$×100%=12.25%;
(3)根据实验数据分析可知,第一次加入20克稀硫酸,有(10-8)gCuO被消耗掉,因此每20克稀硫酸与2克氧化铜恰好完全反应,第四次加入20克稀硫酸后只减小了1克氧化铜,说明前三次每20克稀硫酸与2克氧化铜恰好完全反应,溶质增加和溶液增加成正比,所得溶液的硫酸铜质量分数相等,4、5次溶质增加小于溶液增加比例;所以所得溶液的硫酸铜质量分数P1=P2=P3>P4
故答案为:(1)3; 7.(2)12.25%;
(3)P1=P2=P3>P4
点评 解答本题可用数据分析法,即解题时正确分析数据,找出数据的变化特征及彼此之间的关系,将综合复杂的问题分解为简单的计算,从而顺利解题.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 甲同学推测气体可能是H2,并收集气体用点燃法检验 | |
| B. | 乙同学继续用镁条与该FeCl3溶液反应,观察产生气泡的快慢 | |
| C. | 丙同学用锌粒与该FeCl3溶液反应,观察是否有气泡产生 | |
| D. | 丁同学猜想该FeCl3溶液呈酸性,并用pH试纸检测 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
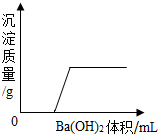 某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( )
某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成,向该溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的关系如图,下列说法正确的是( )| A. | HCl和MgCl2一定存在 | |
| B. | NaOH、H2SO4和MgCl2一定不存在 | |
| C. | HCl和H2SO4一定存在 | |
| D. | HCl一定存在,NaOH、H2SO4一定不存在,MgCl2可能存在 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com