
【题目】某实验小组利用石灰石残渣(杂质不溶于水也不溶于酸)制备轻质CaCO3,同时得到K2SO4,其工艺流程简要如下:
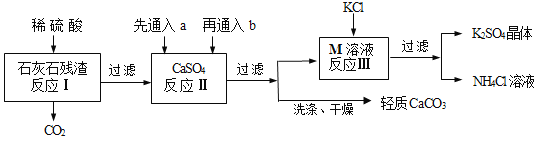
已知:CaCO3 + H2O + CO2 = Ca(HCO3)2
(1)为了提高反应Ⅰ的速率,下列措施中可行的是____(填序号);
①搅拌 ②将残渣粉碎成细小颗粒 ③适当增大硫酸的浓度
(2)反应Ⅱ中a和b分别是____(填序号);
①足量CO2、适量NH3 ②足量NH3、适量CO2
③适量CO2、足量NH3 ④适量NH3、足量CO2
(3)反应Ⅲ中相关物质的溶解度如下表,该表中M物质的化学式为____,反应Ⅲ在常温下能实现的原因是____,生成的NH4Cl溶液在农业上可用作____;
物 质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)将得到的轻质CaCO3进行洗涤,判断CaCO3固体已洗涤干净的方法:取最后一次洗涤液,____(填序号),若无明显的现象,则已洗净;
①滴加稀盐酸
②滴加Na2SO4 溶液
③滴加BaCl2溶液
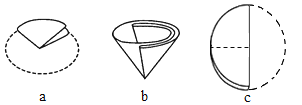
(5)过滤器中的滤纸折叠方法如图所示,正确的顺序是____(填序号);
(6)该工艺流程中可循环利用的物质除H2O外,还有____。
【答案】①②③ ② (NH4)2SO4 常温下,K2SO4的溶解度较低 氮肥(化肥) ③ cab CO2
【解析】
根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息。
(1)①搅拌,可以提高反应物接触机会,加快反应速率;
②将残渣粉碎成细小颗粒,可以增大反应物的接触面积,提高反应速率;
③适当增大硫酸的浓度,增大了反应物的接触机会,提高反应速率;
(2)根据对应的反应物和生成物可以推出反应Ⅱ中a和b分别是足量NH3、适量CO2;利用氨气、二氧化碳、水和硫酸钙反应生成硫酸铵和碳酸钙沉淀,二氧化碳过量会和碳酸钙反应生成碳酸氢钙,所以控制二氧化碳适量;
(3)根据反应Ⅲ中相关物质的溶解度如下表,结合质量守恒定律可得,该表中M物质的化学式为 (NH4)2SO4,反应Ⅲ在常温下能实现的原因是常温下,K2SO4的溶解度较低(相当于复分解反应中生成的沉淀),生成的NH4Cl溶液在农业上可用作氮肥;
(4)判断CaCO3固体已洗涤干净的方法:就是看表面是否有残余的硫酸钙,所以取最后一次洗涤液,滴加BaCl2溶液,若无明显的现象,则已洗净;
(5)过滤器的制作,正确的顺序是 ③①②;
(6)过程生成的二氧化碳可以在后续环节使用,所以该工艺流程中循环利用的物质除了水,还有CO2。


科目:初中化学 来源: 题型:
【题目】近日,北航化学教授杨军关于“虫子吃塑料”的演讲引发关注。研究表明,某种虫子能以塑料为食,能将聚乙烯、聚苯乙烯等降解矿化为CO2或同化为虫体脂肪。
(1)塑料、合成纤维和_________属于合成材料。
(2)昆虫降解塑料属于______变化,它可有效解决的环境问题是________。
(3)聚乙烯由乙烯经聚合制得,乙烯和聚乙烯都由碳、氢元素组成,但它们的化学性质不同,其原因是_______。
下图是乙烯燃烧的微观示意图:

该反应的化学方程式为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是元素周期表中的一部分,下列有关说法中正确的是( )
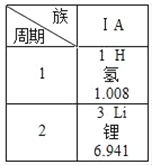
A. 锂原子的质子数为3
B. 氢元素的相对原子质量1.008g
C. 锂元素和氢元素都属于金属元素
D. 锂元素和氢元素属于同周期元素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有失去标签的4种固体物质,分别是BaCl2、BaCO3、Na2CO3和NaHSO4。
(1)在仅提供蒸馏水和所需仪器的条件下,鉴别出上述4种固体物质。
①最先鉴别出来的固体物质是_____。
②利用①中鉴别出来的物质又可直接鉴别出的固体物质是_____,依据的实验现象是_____。
③利用②中鉴别出来的物质即可鉴别出其它物质。
(2)用鉴别出来的物质进行实验:向Na2CO3溶液中滴入BaCl2溶液至恰好完全反应。
①观察到的实验现象是_____。
②下图表示该反应前后溶液中存在的主要离子,写出以下图形代表的离子(填离子符号):
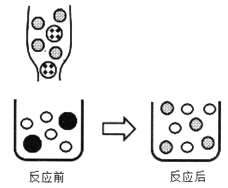
![]() _____
_____![]() _____
_____![]() _____
_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定量Fe2(SO4)3和CuSO4的混合溶液中加入铁粉,搅拌使之充分反应,已知铁粉能与Fe2(SO4)3溶液发生反应:Fe2(SO4)3+Fe=3FeSO4。如图为加入铁粉的质量与烧杯中剩余固体质量关系。下列说法正确的是

A. a点溶液中含有两种溶质
B. m=12.8
C. 取c点固体加入足量稀盐酸,固体全部溶解
D. a点和b点溶液中FeSO4的质量比为3:4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)小杰在一个玻璃瓶中装了半瓶液体,从另一个玻璃瓶中用镊子取出了一些固体颗粒,他把固体的小颗粒用镊子投入瓶中,立即将瘪气球的开口端套住瓶口,再用橡皮筋拉紧,如图1所示,不久,大家看到气球膨胀起来了,如图2,要产生这种现象,则可能的物质组合是:
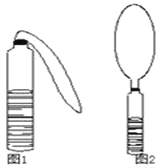
液体 | 固体 | |
可能1 | _____ | _____ |
可能2 | _____ | _____ |
(2)小明在塑料瓶里装了液体后,充入了一种气体,立即拧紧瓶盖,一会儿,瓶子变瘪了,如图2,要产生这种现象,则可能的物质组合是:
液体 | 固体 | |
可能1 | _____ | _____ |
可能2 | _____ | _____ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某环保小组往100g含有H2SO4和CuSO4的废水中,逐滴加入10%的NaOH溶液.测得生成Cu(OH)2沉淀质量与所加NaOH溶液质量关系如图. 下列有关说法不正确的是( )
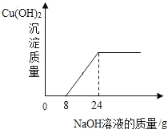
A. 与H2SO4反应的NaOH的质量为0.8g
B. 完全反应时共消耗NaOH溶液的质量为24g
C. 废水中硫酸铜的质量分数为3%
D. 100g废水中含H2SO4的质量为0.98g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在小英家的仓库里,堆放着一袋袋化肥——碳酸氢铵(NH4HCO3)。过了一个夏天,小英发现这种化肥所持有的刺激性气味变得更浓烈了,有些化肥袋里碳酸氢铵变少了,检查发现变少的化肥包装袋没有密封,化肥没有撒落在地上,也没有人进过仓库打开使用。为了探究这些化肥减少的原因,小英在实验室取了一些碳酸氢铵粉末,放在蒸发皿中加热,过一会儿观察到粉末完全消失,同时也闻到了这种刺激性气味。粉末为什么会消失呢?
(提出问题)碳酸氢铵粉末消失的原因是什么?
(猜想)①碳酸氢铵粉末在不加热或加热条件下由固态变成它的气态。
②碳酸氢铵在不加热或加热条件下发生分解反应,可能产生的物质有氨气和一些氧化物。
(查阅资料)①碳酸氢铵属于氮肥,不具有升华的性质,说明上述猜想_____(填序号)不成立;②氨气(化学式NH3)具有特殊的刺激性气味,极易溶于水,其水溶液呈碱性,但干燥的氨气不能使干燥的红色石蕊试纸变蓝;③NO2为红棕色气体。NO为无色气体,在空气中易发生反应:2NO+O2===2NO2 。
(实验操作,现象与结论)
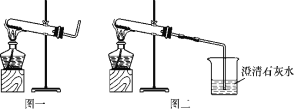
实验操作 | 实验现象 | 实验结论 |
①取适量碳酸氢铵于试管中加热,如图一所示,将干燥的红色石蕊试纸接近导管口 | 产生强烈的刺激性气味,试管壁上有无色液滴且试纸变蓝,但未见红棕色气体 | 分解产物中有____和__,没有________________。 |
②按如图二所示装置继续实验,直到反应完全 | 澄清石灰水变浑浊 | 分解产物有___________。 |
(拓展应用)
①请写出碳酸氢铵发生分解反应的化学方程式____________。
②写出图二中澄清石灰水变浑浊的化学方程式_____________。
③判断:碳酸氢铵是否可用于实验室制取氨气?_______说明理由
④如果你家里有碳酸氢铵化肥,你应该如何保存?______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知所含元素化合价发生变化的反应是氧化还原反应,其中被还原的元素化合价降低,被氧化的元素化合价升高.海洋中有丰富的资源,如图所示利用海水可获得许多化工产品.下列有关说法正确的是( )

A. 第①步中除去粗盐中的SO42﹣、Ca2+、Mg2+等杂质,加入的试剂顺序为:NaOH溶液、Na2CO3溶液、BaCl2溶液,过滤后加盐酸
B. 第②步中加入的试剂为CaCl2溶液
C. 第③步中发生氧化还原反应
D. 在第④步中溴元素被氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com