(1)某同学进行家庭小实验,需要少量氢氧化钠溶液,他用买来的纯碱和熟石灰,制得了氢氧化钠溶液,请你写出化学方程式:
(2)某同学进行制作“叶脉书签”小实验,他将一片具网状叶脉的树叶洗净后,放在约10%的氢氧化钠溶液中煮沸,当叶肉呈黄色后取出用水洗净,再用软牙刷慢慢刷去叶肉,再次用水清洗后晾干,夹在书中压平.该实验中他利用了氢氧化钠 的性质.进行实验时,他应当注意 .
(3)在化工生产中,原料往往不能全部转化为产品.工业上常用电解纯净的饱和食盐水的方法制得烧碱溶液,再经过浓缩、蒸发等步骤,最后得到固体烧碱.请推测在空气中放置一段时间的烧碱样品中,可能含有的杂质是: .
(4)我国东南沿地区某镇的乡镇企业比较发达.他们办有造纸厂、精炼铜厂、海水晒盐厂和硫酸生产厂,经环保局对各厂排放的污水检验获知:①造纸厂排放的污水主要含有NaOH;②精炼铜厂排放的污水主要含有CuCl2;③海水晒盐厂排放的污水主要含有MgSO4;④硫酸厂排放的污水主要含有H2SO4.假若现有①NaOH、②CuCl2、③MgSO4、④H2SO4四种溶液,不用任何试剂依次鉴别出的顺序为(用序号填写) .
(5)向40g 5%的NaOH溶液中,加入60g10%的NaOH溶液,混合后的溶液中NaOH的质量分数为 ;上述混合溶液恰好能跟 g 10%的稀硫酸完全反应.
【答案】
分析:本题考查碱的化学性质.
(1)根据习题中信息纯碱和熟石灰制氢氧化钠来写反应方程式.
(2)考查在使用氢氧化钠时应注意其腐蚀性.
(3)利用饱和食盐水的制氢氧化钠时可能有剩余的氯化钠,还可能在空气中放置一段时间,与二氧化碳发生反应.
(4)考查利用离子在水中的颜色和复分解反应来鉴别,注意鉴别的顺序,根据颜色,首先判断出含有CuCl
2的污水.
(5)利用混合前后的质量守恒和酸碱反应的量的关系来解答.
解答:解:(1)由纯碱和熟石灰制氢氧化钠,根据守恒还要生成碳酸钙,故答案为:Na
2CO
3+Ca(OH)
2=2NaOH+CaCO
3↓.
(2)利用氢氧化钠将树叶中果胶质腐蚀掉,性质变稳定可保存长久,使用应注意安全,故答案为:有强烈腐蚀性;在使用氢氧化钠时必须十分小心,防止眼睛、皮肤、衣服被它腐蚀.
(3)在制取中,可能有剩余的氯化钠,还可能存在与二氧化碳发生生成的碳酸钠,故答案为:NaCl、Na
2CO
3.
(4)Cu
2+在水中显蓝色,先确定②,能与其反应得到蓝色沉淀的,含有碱,从而确定①,再利用①根据有白色沉淀确定③或根据无明显现象来确定④,故答案为:②①③④或②①④③.
(5)根据混合前后溶质的质量守恒,设混合后的溶液中NaOH的质量分数为 w,则:
40×5%+60×10%═100×w,
解得w═8%,
设混合溶液恰好能跟xg 10%的稀硫酸完全反应.则
2NaOH+H
2SO
4═Na
2SO
4+H
2O
2×40 98
100×8% x×10%
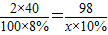
解得:x═98g,
故答案为:8%;98.
点评:本题考查点多,综合性强,并具有较强的实际应用性,体现化学在生活和生产中的重要价值,通过本题要掌握解决方法,能通过化学方程式来进行简单计算.



 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案