
【题目】自来水厂常用氯气杀菌消毒,用明矾、氯化铁等净化水。以硫铁矿(主要成分是FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的流程如图:

(1)已知“焙烧”阶段就是硫铁矿的燃烧,生成物是Fe2O3和SO2,写出该反应的化学方程式 _________________,硫铁矿进行燃烧前要将其粉碎,其目的是____________。
(2)大量排放出的SO2能形成_________,危害环境,可将含SO2的废气通入氨水中,氨水的pH______7,反应后生成的亚硫酸铵[(NH4)2SO3]在农业上可做__________肥。
(3)①流程中用30%盐酸“酸溶”焙烧后的残渣,写出化学方程式_________;
②在“酸溶”时是否可以用硫酸代替盐酸?________(填“可以”或“不可以”),原因是____;
③若在实验室欲用38%(密度为1.18 g/ml)的盐酸配制30%的盐酸,则需要的玻璃仪器有烧杯、胶头滴管、________、________等。
(4)实际上“焙烧”阶段很难做到将硫铁矿完全反应,因“酸溶”后的混合物中有FeCl2,将其在“氧化”阶段与氯气(Cl2)反应生成FeCl3,写出化学方程式__________________。
【答案】 4 FeS2 + 11 O2 点燃 2 Fe2O3 + 8 SO2 加快反应速率,使反应更充分 酸雨 > 氮 Fe2O3 + 6 HCl = 2 FeCl3 + 3 H2O 不可以 反应后不能生成FeCl3 玻璃棒 量筒 2 FeCl2 + Cl2 = 2 FeCl3
【解析】(1)根据题中的叙述找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式;根据增大反应物的接触面积可以加快反应速率进行分析;(2)根据大量排放出的SO2能形成酸雨,氨水是一种常见的碱分析,根据硫酸铵含有氮元素分析;(3)①根据氧化铁与盐酸的反应写出反应的化学方程式;②根据硫酸和氧化铁反应会生成硫酸铁进行分析;③根据实验室配制一定溶质质量分数的溶液解答;(4)根据题中的反应原理找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式。(1)硫铁矿和氧气在点燃的条件下生成氧化铁和二氧化硫,化学方程式为4FeS2+11O2![]() 2Fe2O3+8SO2;增大反应物的接触面积可以加快反应速率,所以硫铁矿进行燃烧之前要将其粉碎,增大了反应物的接触面积,其目的是:加快反应速率,使反应更充分;(2)大量排放出的SO2能形成酸雨,氨水是一种常见的碱,氨水的pH>7,反应后生成的亚硫酸铵[(NH4)2SO3](含有氮元素)在农业上可做氮肥;(3)流程中需用30%的盐酸“酸溶”焙烧后的残渣,盐酸和氧化铁反应生成氯化铁和水,化学方程式为Fe2O3+6HCl═2FeCl3+3H2O,“酸溶”时可改用硫酸,硫酸和氧化铁反应生成硫酸铁和水,而题中需要制备氯化铁晶体,所以不能改用硫酸,原因是反应后不能生成FeCl3;(4)通过分析题中的反应原理,酸溶后的混合物中通入氯气制取氯化铁,氯气和氯化亚铁反应生成氯化铁,化学方程式为2FeCl2+Cl2═2FeCl3。
2Fe2O3+8SO2;增大反应物的接触面积可以加快反应速率,所以硫铁矿进行燃烧之前要将其粉碎,增大了反应物的接触面积,其目的是:加快反应速率,使反应更充分;(2)大量排放出的SO2能形成酸雨,氨水是一种常见的碱,氨水的pH>7,反应后生成的亚硫酸铵[(NH4)2SO3](含有氮元素)在农业上可做氮肥;(3)流程中需用30%的盐酸“酸溶”焙烧后的残渣,盐酸和氧化铁反应生成氯化铁和水,化学方程式为Fe2O3+6HCl═2FeCl3+3H2O,“酸溶”时可改用硫酸,硫酸和氧化铁反应生成硫酸铁和水,而题中需要制备氯化铁晶体,所以不能改用硫酸,原因是反应后不能生成FeCl3;(4)通过分析题中的反应原理,酸溶后的混合物中通入氯气制取氯化铁,氯气和氯化亚铁反应生成氯化铁,化学方程式为2FeCl2+Cl2═2FeCl3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】化学兴趣小组同学发现实验台上按如图所示顺序摆放着6瓶不同的无色溶液(如图所示:A、B、C、D、E、F代表对应的溶液)。其中E溶液的试剂瓶标签破损.为此,他们做了如下探究:
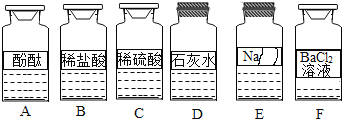
【提出问题】E溶液的成分是什么?
【初步判断】根据受损标签及实验室药品分类摆放原则,E溶液不可能是_______(填序号)①酸;②碱;③盐。
【提出猜想】
猜想Ⅰ:NaOH溶液;
猜想Ⅱ:Na2CO3溶液;
猜想Ⅲ:Na2SO4溶液;猜想Ⅳ:____溶液(任写一种).
设计并实验兴趣小组的同学为验证“猜想Ⅱ”是否正确,设计并完成如下表所示实验。
实验方案 | 实验一 | 实验二 | 实验三 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对照比色卡,pH>7 | 有无色无味气体产生 | _____________ |
实验结论 | 猜想Ⅱ正确 | ||
【分析与推理】
①完成“实验一”后,李成同学即认为“猜想Ⅰ”正确,张平同学认为“猜想Ⅰ”不一定正确,他的理由是_________________________。
②请写出“实验三”中发生反应的化学方程式___________________________。
【反思与评价】
经过讨论,同学们认为实验中存在明显操作错误,该错误是___________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一份碳酸钠和硫酸钠的混合粉末,为测定其中碳酸钠和硫酸钠的质量比,小冰做了如图所示的实验:
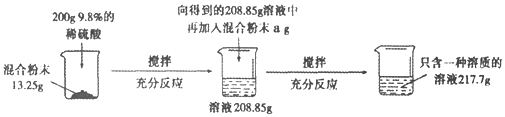
请回答下列问题:
(1)上述实验过程中发生反应的化学方程式为____________________________;
(2)向13.25g样品中加入200g稀硫酸后,生成气体的质量为_______________;
(3)根据已知条件,列出求解与13.25g样品反应的稀硫酸中溶质质量(x)的比例式________________;
(4)a的数值是_________;
(5)混合粉末中碳酸钠和硫酸钠的质量比为_________;
(6)若要使最终所得溶液溶质的质量分数变为10%,则需要向其中加入水的质量为____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】数型图象是研究化学问题的一种常见描述方法,根据下列图象进行回答:
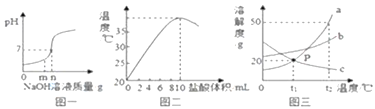
(1)图一是用盐酸和氢氧化钠进行中和反应时,反应过程中溶液的pH变化曲线.向盐酸中加入的氢氧化钠溶液质量为mg时,所得溶液中含有的离子为__________(填离子符号);
(2)图二是20℃时,取10mL10%的NaOH溶液于烧杯中,逐滴加入10%的盐酸,随着盐酸的加入,烧杯中溶液温度与加入盐酸体积的变化关系.
①由图可知中和反应是放热反应,你的依据为__________;
②甲同学用氢氧化钠固体与稀盐酸反应也能得到相同结论,乙同学认为不严密,因为__________;
(3)图三是a、b、c三种物质的溶解度曲线.a与c的溶解度相交于P点,据图回答:
①t1℃时,接近饱和的c物质溶液,在不改变溶液质量的条件下,可用_________的方法达到饱和状态;
②将t2℃时,150ga物质的饱和溶液降温到t1℃时,可以析出______物质.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将20g黄铜(由铜、锌组成的合金)样品研磨成粉末,再加入10%的稀硫酸充分反应,所加稀硫酸与生成气体的质量关系如图。请计算:
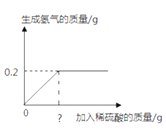
(1)将黄铜研磨成粉末的目的是__________________.
(2)样品中铜的质量为___________?
(3)图中“?”处应标注的稀硫酸质量应为______________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据装置图回答下列有关问题(K、K1、K2、K3为止水夹):
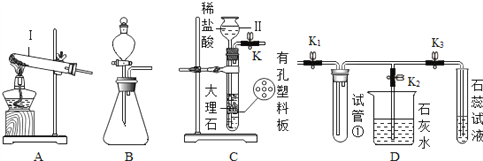
(1)写出图中标号仪器的名称:I_____、II______.
(2)欲用过氧化氢溶液制氧气,可选用_____发生装置(填“A”或“B”),请写出该反应的化学方程式______。
(3)将C和D装置相连接能制备CO2并验证CO2的性质.连接C和D装置,关闭K2,打开K、K1、K3,用试管①收集CO2,此收集方法说明_____。石蕊试液最终呈_____色,使石蕊试液变色的微粒符号是______。
(4)关闭K3,打开K1、K2,烧杯中反应的化学方程式_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)A~G均为初中化学中常见的物质:其中A、C组成元素相同,E是红色单质。下图是它们之间的转化关系,请回答:
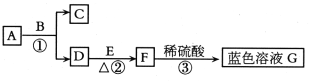
写出反应①的化学方程式 ,其中B物质在该反应中起 作用。
反应②中的现象为 。
反应③的基本类型是 反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
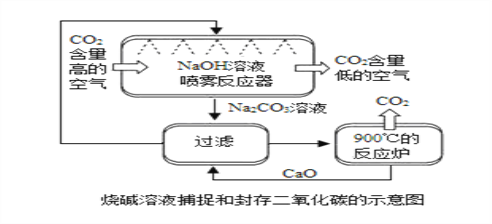
【题目】为了减少空气中的温室气体,并且充分利用二氧化碳资源,科学家们设想了一系列捕捉和封存二氧化碳的方法。
CaO
烧碱溶液捕捉和封存二氧化碳法(见上图):
①喷雾反应器中,发生反应的化学方程式为________,CO2+2NaOH═Na2CO3+H2ONaOH溶液喷成雾状的目的是 _________。
增大气体与液体的接触面积,使反应更充分
②过滤环节中所得滤渣的主要成分是 _____,CaCO3请用化学方程式说明原因:________,_______。
CaO+H2O═Ca(OH)2
③在整个流程中,循环利用的物质有 ____________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源、河水净化的主要步骤如图1所示.
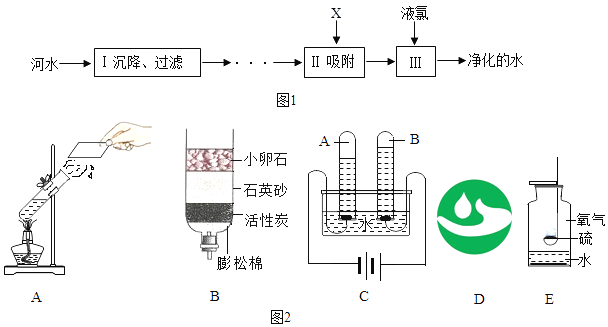
回答下列问题:
(1)除去水中不溶性的杂质操作是________
(2)除去水中的色素和异味所用的物质是________、它具有________性
(3)下列叙述正确的是_______
A. 明矾可以软化硬水 B. 为了检验净化后的水是硬水还是软水,可用肥皂水
C. 上述步骤Ⅲ目的是杀菌、消毒 D. 上述步骤中的沉降、过滤、吸附都属于物理变化
E. 软水就是不含可溶性钙、镁化合物的水
(4)爱护水资源人人有责,写出防止水资源污染的一种方法________
(5)如图2都和水有关的装置及标志,回答下列问题: ①A装置是加热水实验,用分子知识解释:________
②B装置是最简易的净水装置,其中小卵石、石英砂、膨松棉起的作用是________
③C装置是电解水实验,根据此实验得到的结论是________
④该图示是节水标记,它的寓意是________
⑤E装置是硫粉在氧气中燃烧,观察到的现象是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com