
【题目】化学链燃烧是新的燃烧概念,即燃料不直接与空气接触燃烧,而是以载氧体(如CaSO4等)在两个反应器之间的循环来实现燃料的燃烧过程(如图1)。请回答下列问题:
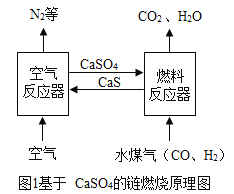
(1)空气反应器中主要发生化合反应,化学方程式为_____。燃料反应器中, CO与CaSO4发生的反应方程式为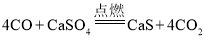 。
。
(2)实验室模拟CO与石膏(CaSO4﹒2H2O)的反应,并测定CO与石膏(CaSO4﹒2 H2O)是否反应完全,设计装置如图2。
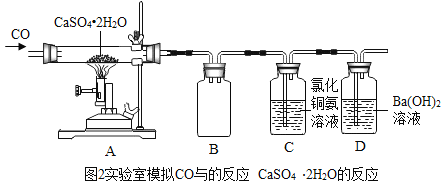
①广口瓶B的作用是_____。C中反应的化学方程式为![]() _____
_____![]() ,C装置的作用是_____,该实验的尾气无毒。
,C装置的作用是_____,该实验的尾气无毒。
②完成实验报告(已知:热的CaS会跟氧气反应;氯化亚铜和氨水混合溶液为无色)。
实验步骤 | 现象 | 分析与解释 |
检查气密性并装填好药品后,首先应先通一会CO | C中_____(填反应现象) | |
点燃A处酒精喷灯 | D中_____(填反应现象) | |
停止加热,继续通一会CO,直到装置冷却 | 继续通CO目的:(1)使生成的CO2全部被氢氧化钡溶液吸收; (2)_____ | |
取A中残留固体,加足量稀盐酸 | _____(填反应现象),有少量不溶物 |
|
(3)若所取石膏样品(CaSO4﹒2 H2O)质量为1.00g,装置D中产生的BaCO3的质量为3.94g,求石膏样品的转化率。_____(转化率:![]() ,己知BaCO3的相对分子质量为197)(写出计算过程)
,己知BaCO3的相对分子质量为197)(写出计算过程)
(4)D装置中不宜使用澄清石灰水的理由是_____。
【答案】![]() 安全瓶(或防止倒吸) 2CO 除去CO(吸收没有参加反应的CO) 出现红色固体, 出现白色浑浊 防止CaS在热的情况下被氧化 出现气泡 不完全 86% 氢氧化钙微溶于水,一定量的澄清石灰水中所含溶质少,吸收CO2不完全
安全瓶(或防止倒吸) 2CO 除去CO(吸收没有参加反应的CO) 出现红色固体, 出现白色浑浊 防止CaS在热的情况下被氧化 出现气泡 不完全 86% 氢氧化钙微溶于水,一定量的澄清石灰水中所含溶质少,吸收CO2不完全
【解析】
(1)空气反应器中空气进入,氮气排出,说明氧气参加了反应,空气反应器中另外加入的物质是硫化钙,又已知该反应是化合反应,所以该反应中反应物是CaS和O2,生成物是硫酸钙,化学方程式为:![]() 。燃料反应器中, CO与CaSO4发生的反应方程式为:
。燃料反应器中, CO与CaSO4发生的反应方程式为:![]() 。
。
(2)实验室模拟CO与石膏(CaSO4﹒2H2O)的反应,并测定CO与石膏(CaSO4﹒2 H2O)是否反应完全,设计装置如图2。
①图中广口瓶B的作用是:做安全瓶(或防止倒吸),因为两个导气管都是稍微露出橡皮塞,所以实验中即使C中有液体倒流,也不会进入A中,不会导致A中的玻璃管炸裂。题中需要补充完整的化学方程式是:2CuCl+_____+4NH3+2H2O=2Cu↓+(NH4)2C2O4+2NH4Cl,根据化学反应前后原子的种类和数目不变,该反应生成物中各原子的个数是:Cu:2,N:4,H:16,C:2,O:4,Cl:2;反应物中已知的各原子个数是:Cu:2,N:4,H:16,O:2,Cl:2,可见反应前缺少:C:2 ,O:2,因此方程式中需补充:2CO;图②CO与CaSO4反应过程中可能有少量CO没有参加反应,CO有毒,如果直接排放会污染空气,且题中已经说明该实验的尾气无毒,可见没有参加反应的CO已经被C装置除去,因此C装置的作用是:除去CO(或吸收没有参加反应的CO)。
②完成实验报告
检查气密性并装填好药品后,首先应先通一会CO,根据反应2CuCl+2CO+4NH3+2H2O=2Cu↓+(NH4)2C2O4+2NH4Cl,CO进入C中与氯化亚铜和氨水混合溶液反应会生成铜,故C中现象为:出现红色固体(或沉淀);
点燃A处酒精喷灯,根据题中提供的信息: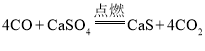 ,反应中生成CO2,因为Ba(OH)2+CO2=BaCO3↓+H2O,碳酸钡是难溶于水的白色固体,故D中出现白色浑浊现象;
,反应中生成CO2,因为Ba(OH)2+CO2=BaCO3↓+H2O,碳酸钡是难溶于水的白色固体,故D中出现白色浑浊现象;
停止加热,继续通一会儿CO,直到装置冷却,继续通CO目的:(1)将玻璃管内残留的二氧化碳排入装置D中,使生成的CO2全部被氢氧化钡溶液吸收;(2)根据题中提供的信息,热的CaS会跟氧气反应,因此继续通CO的另一目的是防止CaS在热的情况下被氧化;
取A中残留固体,加足量稀盐酸,A中残留的固体中一定含有硫化钙,根据提供的实验结论,CaS会和稀盐酸反应生成硫化氢气体,所以出现的现象应该是:有气泡冒出;因为硫酸钙不能和稀盐酸反应,所以仍然有不溶物,说明有硫酸钙没有完全转化,故填:不完全。
(3)计算石膏样品的转化率。
设反应中生成二氧化碳的质量为x。
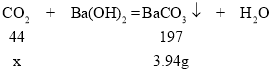
![]()
解得x=0.88g
设参加反应的硫酸钙的质量为y。
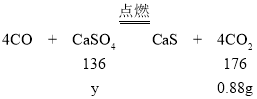
![]()
解得y=0.68g
根据计算得到的参加反应的CaSO4质量和石膏的化学式CaSO4﹒2H2O,参加反应的CaSO4﹒2H2O质量为:
根据转化率计算公式,石膏样品的转化率:![]() 。
。
(4)因为氢氧化钙微溶于水,一定量的澄清石灰水中所含溶质少,吸收CO2不完全,所以D装置中不宜使用澄清石灰水。而氢氧化钡易溶于水,一定量的氢氧化钡溶液中含有的溶质多,二氧化碳能被完全吸收,实验结果准确。


科目:初中化学 来源: 题型:
【题目】已知NaHCO3受热分解生成Na2CO3,![]() 。把12克NaHCO3和Na2CO3的混合物样品加热至完全反应,剩余固体的质量为8.9克。下列说法正确的是( )
。把12克NaHCO3和Na2CO3的混合物样品加热至完全反应,剩余固体的质量为8.9克。下列说法正确的是( )
A. 反应生成的CO2质量为4.4克B. 样品中Na2CO3的质量分数为30%
C. 样品中NaHCO3的质量为8.6克D. 样品中钠元素的质量分数为43.3%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫化钠是重要化工产品,主要用于皮革、毛纺、高档纸张、染料等行业。工业上利用工业尾气硫化氢(H2S)制得产品硫化钠固体。其工业流程示意图如下图:
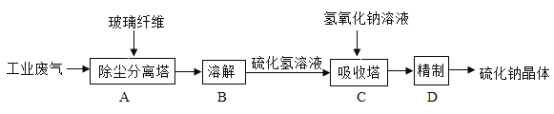
(1)图中A操作利用玻璃纤维作除尘分离塔的滤材,玻璃纤维的作用是过滤,该操作在实验室里要使用玻璃棒的作用为_____。
(2)硫化氢中硫元素的化合价为_____。硫化氢气体能溶于水,其水溶液呈酸性,称为氢硫酸,则其pH_____(填“<”、“>”或“=”)7。
(3)目前采用氢氧化钠溶液吸收工业尾气中的硫化氢,可减少空气污染。吸收塔中氢氧化钠溶液与硫化氢溶液发生硫化钠和水,写出该反应的化学方程式为_____,其基本类型为_____。
(4)产品硫化钠的物质类别属于_____(“酸”、“碱”、“盐”或“氧化物”)。硫化钠固体在空气中易氧化并易溶于水,保存硫化钠的正确方法为_____。
(5)硫化钠的溶解度随着温度升高明显增大。D操作中精制过程,从硫化钠的饱和溶液中分离出硫化钠晶体,采用的结晶方法是_____(填“蒸发溶剂”或“降温结晶”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图回答问题:
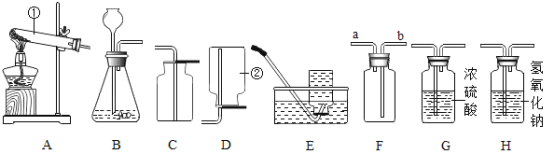
(1)写出装置图中的仪器名称:①_______,②________。
(2)实验室用高锰酸钾加热制取氧气,应选用的发生装置是___________,收集装置可选用_______或_________,请写出该反应的文字表达式_______________________。
(3)若用B装置制取氧气需要药品_________________________,请写出该反应的文字表达式________________________,装药品之前应进行操作___________________。
(4)F是一个多功能瓶,若用F装置排空气法收集氧气,则氧气应从_____________(填“a”或“b”)端进入;若F装置内装满水收集氧气时,此时氧气应由_____________(填“a”或“b”)端进入。为了得到干燥的氧气可通过____________装置吸收水蒸气。
(5)已知SO2是一种有毒气体,密度比空气大,能溶于水,能和NaOH溶液发生反应生成盐和水,为了防止SO2污染环境,可用____________装置吸收。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~H是初中常见的物质,已知A~G七种物质均含有同一种元素, D的相对分子质量为100,可用作建筑材料。它们之间的转化关系如图所示,图中“一”表示两端物质间能发生化学反应,“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。下列说法中不正确的是
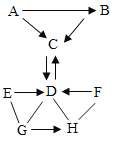
A.A为一种单质,D为碳酸钙
B.可能涉及四种基本反应类型
C.E、F的物质类别可能相同,也可能不同
D.H的浓溶液具有挥发性
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明在收拾实验室时发现有一瓶没有盖瓶盖的氢氧化钙固体,报告老师后,老师告诉同学们这瓶固体可能已经变质了。于是小明和小组的同学们一起探究这瓶久置于空气中的氢氧化钙固体的成分。
(提出问题):久置于空气中的氢氧化钙固体的成分?
(猜 想):猜想 1:氢氧化钙 猜想 2:碳酸钙 猜想 3:_______
(实验验证):
实验步骤 | 实验现象 | 实验结论 |
(1)取少量固体样品于试管中,加入一定的水振荡,静置 | ||
(2)取步骤(1)中的上层清液,滴加 2-3 滴无色酚酞试液,振荡 | ______ | 样品中含有氢氧化钙 |
(3)往上面试管中的剩余固体中倒入足量的稀盐酸 | ______ | 样品中含有碳酸钙 |
(得出结论):猜想 3 正确
(实验反思):上述实验中产生气泡的化学方程式为:______
(拓展提升):进一步探究这瓶氢氧化钙固体的变质程度,计算固体样品中氢氧化钙的质量分数?
(实验设计):小明和同学们设计了如下图所示的实验装置来测定样品中氢氧化钙的质量分数(铁架台、 铁夹等在图中均已省略)
(资料):饱和碳酸氢钠溶液可以吸收盐酸挥发出来的 HCl 气体;碱石灰为 NaOH 和 CaO 的混合物;装置 F 用于吸收空气的气体
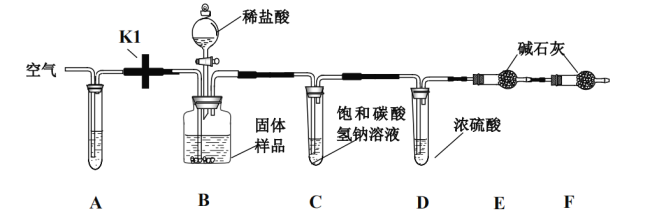
(实验步骤):
①准确称量 10.0g 固体样品装入装置 B
②将装置 B 分别与 A、C、D 连接,打开开关 K1,从 A 处鼓入空气,几分钟后,将开关 K1 关闭,再将已 称量过的干燥管 E、F 与 D 连接
③打开 B 中分液漏斗的活塞,再向 B 中缓缓的注入足量的稀盐酸
④待完全反应后,再次打开开关 K 缓缓鼓入空气几分钟,最后称量干燥管 E,增重 1.1g
(实验分析)
(1)已知装置 A 中试剂为某种碱性溶液,其作用是为了吸收空气中的某气体,写出吸收该气体所发生的
化学反应方程式:______________,实验前第一次鼓入空气是为了驱赶装置中的该气体,若反应后不鼓入空气,对测定结果的影响是_____________(填“偏大”或“偏小”)
(2)D 装置的作用是_____。
(3)根据干燥管 E 增加的质量,可推算出样品中氢氧化钙的质量分数为_______。
(4)实验结束后,同学们认为反应后的酸性废液不能直接进行排放,应该进行处理以后再排放,正确的处理方法是加入过量的______
A 熟石灰 B 碳酸钙 C 生石灰 D 氢氧化钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,回答下列问题:

(1)A点的含义是_____。
(2)若乙中混有少量甲,最好采用_____的方法提纯乙(填“降温结晶”或“蒸发结晶”)。
(3)将30℃时甲、乙、丙三种物质的饱和溶液降温到10℃,则其溶质质量分数不变的物质是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向Na2CO3溶液中加入一定量MgCl2溶液,出现白色沉淀。某同学经过过滤洗涤、低温烘干得白色固体,并进行如下探究:
(猜测)白色固体可能是:①MgCO3;②Mg(OH)2;③_____。
(资料)MgCO3、Mg(OH)2加热易分解,生成对应的两种氧化物。
(实验1)
(1)取适量白色固体,充分加热,将产生的气体通过装有无水硫酸铜的U形管,观察到现象为_____,则猜测①不成立。
(2)另取适量白色固体于试管中,加入_____,产生大量气泡,则猜测②不成立。有同学查阅资料得知上述固体应为碱式碳酸镁[aMgCO3·bMg(OH)2·3H2O],其不溶于水,加热易分解,工业上常用作阻燃剂。
(实验2)
(3)为进一步确定白色固体的组成,该同学取适量白色固体,充分加热至质量不再改变,并使产生的气体全部缓缓通过如图_____(选填“甲”或“乙”)装置,实验中浓硫酸的作用_____,浓NaOH溶液的作用_____。若错选为乙装置,则a:b的值会_____(填“变大”、“变小”或“不确定”)。根据实验测得的数据,经计算得知该碱式碳酸镁的化学式为[3MgCO3·Mg(OH)2·3H2O]。

(拓展延伸)
(4)将该碱式碳酸镁长期浸泡在浓NaOH溶液中,固体全部转化为Mg(OH)2,写出此反应的化学方程式_____。
(5)工业上用碱式碳酸镁作阻燃剂,其可能的原因有_____。
a.分解时吸热,降低可燃物的着火点
b.生成的固体覆盖燃烧物,隔绝氧气
c.生成的气体稀释了可燃物周围的氧气浓度
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室用海水晒盐后的卤水(含Mg2+等)制取氯化镁晶体(MgCl2 6H2O):

(1)为提高产率,试剂X应选用_____________(选填序号)。
a 饱和石灰水
b 石灰乳
(2)操作A中,所用玻璃仪器有_____________玻璃棒、烧杯。
(3)操作B为蒸发浓缩、______________、过滤、洗涤。
(4)操作B中洗涤时不可选用______________(选填序号)。
a 热水
b 冰水
c 饱和MgCl2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com